よむ、つかう、まなぶ。
資料1-3-2 新型コロナワクチン接種後の死亡として報告された事例の概要(スパイクバックス筋注) (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00055.html |
| 出典情報 | 第 88 回厚生科学審議会予防接種・ワクチン分科会 副反応検討部会、令和4年度第 18 回薬事・食品衛生審 議会薬事分科会医薬品等安全対策部会安全対策調査会(11/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
専門家による評価【令和4年10月7日時点】
No
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
死因等
(報告者による見解・考察等)
ロット番号
接種回数
基礎疾患等
報告書上の記載
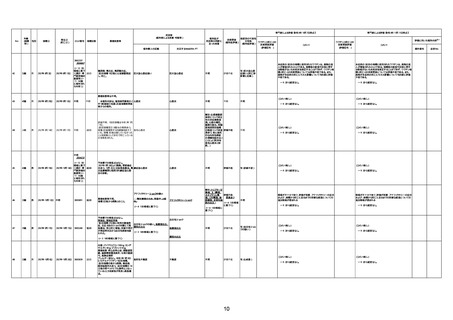
206
77歳
女
2022年9月6日
2022年9月9日
000232A
4回目
2018年の脳梗塞後遺症(右片麻痺、
失語)にて寝たきり状態。2019年10月
より入院しておりCVカテーテル留置
にて高カロリー輸液行っていた。全身
状態は安定していた。これまで3回新
型コロナワクチン接種を施行するも
問題なし。3回目まではファイザー
製。4回目はモデルナ製ワクチンを接
種。当日の接種前後は全身状態異
常なかったが、接種翌日に37.8度の
発熱出現。さらに接種翌々日には
心筋炎
40.7度の高熱とHR130の頻脈、血圧
低下、チアノーゼあり。接種3日後も
40.8度の高熱と心室頻拍出現。血液
検査ではWBC13700、CRP18.40、
CK2373と上昇あり。トロポニンTおよ
びH-FABPはいずれも陽性。しかし心
エコーではACSは否定的であった。
当院循環器内科専門医に相談したと
ころ新型コロナワクチン接種による心
筋炎の可能性は否定できないとのこ
と。接種3日後18:30に死亡確認。
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
対応するMedDRA PT
心筋炎
不明
関連あり
他要因の可能性
の有無
ワクチンと死亡との
(報告医評価)
因果関係評価
(評価記号★)
無
-
コメント
-
専門家による評価【令和4年11月11日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
-
評価中
資料番号
症例No
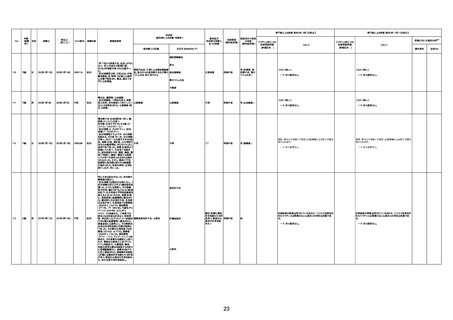
接種12日後、全身倦怠感にて救急
搬送。心電図にて完全房窄ブロック。
心エコーにて心筋肥厚、心機能低下
あり。冠動脈造影では狭窄なし。一
207
69歳
女
2022年8月22日 2022年9月30日 000236A
4回目
時PM留置、IABP留置。接種15日後 不明
不明
不明
関連あり
無
PCPS留置。ガンマグロブリン投与。
ステロイドパルス療法施行。しかし心
筋壊死あり、心機能改善せず。接種
39日後死亡確認。
基礎疾患等:糖尿病、高血圧
併用薬:報告なし
2021年6月21日本剤2回目を接種し
た。日付不明 呼吸障害が発現。2回
目接種の34日後、発熱及び嘔吐の
ため来院。2022年7月3日心筋炎が
発現。重度の炎症反応を示し、感染
208
80歳
女
2021年6月21日 2022年7月8日
不明
2回目
心筋炎
心筋炎
剖検
不明
不明
に対する抗生物質による治療を受け
た。左室壁運動低下、血性心嚢液貯
留が報告されており、心筋炎は左室
壁を中心とした広範囲に認められる
と考えられた。また、間質に線維症が
あった。2022年7月8日呼吸状態悪化
し、 死亡した。
注1:各症例の記載は、令和3年5月22日〜令和4年10月28日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年10月9日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注4:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
注5:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注6:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注7:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注8:接種医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:搬送医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
42
-
-
-
評価中
-
-
-
評価中
No
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
死因等
(報告者による見解・考察等)
ロット番号
接種回数
基礎疾患等
報告書上の記載
206
77歳
女
2022年9月6日
2022年9月9日
000232A
4回目
2018年の脳梗塞後遺症(右片麻痺、
失語)にて寝たきり状態。2019年10月
より入院しておりCVカテーテル留置
にて高カロリー輸液行っていた。全身
状態は安定していた。これまで3回新
型コロナワクチン接種を施行するも
問題なし。3回目まではファイザー
製。4回目はモデルナ製ワクチンを接
種。当日の接種前後は全身状態異
常なかったが、接種翌日に37.8度の
発熱出現。さらに接種翌々日には
心筋炎
40.7度の高熱とHR130の頻脈、血圧
低下、チアノーゼあり。接種3日後も
40.8度の高熱と心室頻拍出現。血液
検査ではWBC13700、CRP18.40、
CK2373と上昇あり。トロポニンTおよ
びH-FABPはいずれも陽性。しかし心
エコーではACSは否定的であった。
当院循環器内科専門医に相談したと
ころ新型コロナワクチン接種による心
筋炎の可能性は否定できないとのこ
と。接種3日後18:30に死亡確認。
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
対応するMedDRA PT
心筋炎
不明
関連あり
他要因の可能性
の有無
ワクチンと死亡との
(報告医評価)
因果関係評価
(評価記号★)
無
-
コメント
-
専門家による評価【令和4年11月11日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
-
評価中
資料番号
症例No
接種12日後、全身倦怠感にて救急
搬送。心電図にて完全房窄ブロック。
心エコーにて心筋肥厚、心機能低下
あり。冠動脈造影では狭窄なし。一
207
69歳
女
2022年8月22日 2022年9月30日 000236A
4回目
時PM留置、IABP留置。接種15日後 不明
不明
不明
関連あり
無
PCPS留置。ガンマグロブリン投与。
ステロイドパルス療法施行。しかし心
筋壊死あり、心機能改善せず。接種
39日後死亡確認。
基礎疾患等:糖尿病、高血圧
併用薬:報告なし
2021年6月21日本剤2回目を接種し
た。日付不明 呼吸障害が発現。2回
目接種の34日後、発熱及び嘔吐の
ため来院。2022年7月3日心筋炎が
発現。重度の炎症反応を示し、感染
208
80歳
女
2021年6月21日 2022年7月8日
不明
2回目
心筋炎
心筋炎
剖検
不明
不明
に対する抗生物質による治療を受け
た。左室壁運動低下、血性心嚢液貯
留が報告されており、心筋炎は左室
壁を中心とした広範囲に認められる
と考えられた。また、間質に線維症が
あった。2022年7月8日呼吸状態悪化
し、 死亡した。
注1:各症例の記載は、令和3年5月22日〜令和4年10月28日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年10月9日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注4:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
注5:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注6:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注7:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注8:接種医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:搬送医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
42
-
-
-
評価中
-
-
-
評価中