よむ、つかう、まなぶ。
【資料1】基本要件基準の一部改正について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30272.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第9回 1/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
資料1
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第四十
一条第三項の規定により厚生労働大臣が定める医療機器の基準の一部を改正
する件(案)について(概要)
令 和 4 年 1 2 月
医 薬 ・ 生 活 衛 生 局
医 療 機 器 審 査 管 理 課
1 改正の趣旨
○ 医療機器の性状、品質及び性能の適正を図るための基準として、薬事法第四十一条第三
項の規定により厚生労働大臣が定める医療機器の基準(平成 17 年厚生労働省告示第 122
号。以下「基本要件基準」という。
)が策定され、基本要件基準第2条の規定に基づき、
医療機器の設計及び製造に係る製造販売業者又は製造業者は、最新の技術に立脚して医療
機器の安全性を確保し、危険性の低減が要求される場合は当該危険性を管理しなければな
らないこととされていた。
○ 薬事法等の一部を改正する法律(平成 25 年法律第 84 号)による医薬品、医療機器等の
品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145 号。以下「法」と
いう。)の施行に伴い、医療機器プログラムが新設され、プログラムを用いた医療機器に
おける基本要件基準についても改正されたところである(平成 26 年厚生労働省告示第 403
号)。
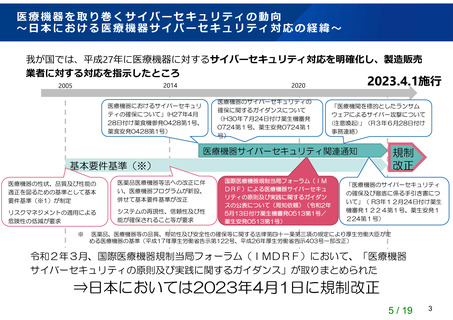
○ 今般、令和2年3月に国際医療機器規制当局フォーラム(IMDRF)において、
「医療機器
サイバーセキュリティの原則及び実践に関するガイダンス」が取りまとめられたことに伴
い、そのガイダンスの一部の文書(IMDRF N47 及び N60 文書)の内容を踏まえたプログラ
ムを用いた医療機器における基本要件基準の改正を行う。
2 改正の内容
○ IMDRF ガイダンスにおいて取りまとめられたサイバーセキュリティを確保するための
要件として、
① 製品の全ライフサイクルに渡って医療機器サイバーセキュリティを検討する計画を
備えること
② サイバーリスクを低減する設計及び製造を備えること
③ 適切な動作環境に必要となるハードウェア、ネットワーク、IT セキュリティ対策の最
低限の要件を設定すること
の3つの観点を基本要件基準に盛り込む改正を行う。
3
根拠規定
法第 41 条第3項
4 告示日等
告 示 日:令和5年2月下旬(予定)
適用期日:令和5年4月1日
1 / 19
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第四十
一条第三項の規定により厚生労働大臣が定める医療機器の基準の一部を改正
する件(案)について(概要)
令 和 4 年 1 2 月
医 薬 ・ 生 活 衛 生 局
医 療 機 器 審 査 管 理 課
1 改正の趣旨
○ 医療機器の性状、品質及び性能の適正を図るための基準として、薬事法第四十一条第三
項の規定により厚生労働大臣が定める医療機器の基準(平成 17 年厚生労働省告示第 122
号。以下「基本要件基準」という。
)が策定され、基本要件基準第2条の規定に基づき、
医療機器の設計及び製造に係る製造販売業者又は製造業者は、最新の技術に立脚して医療
機器の安全性を確保し、危険性の低減が要求される場合は当該危険性を管理しなければな
らないこととされていた。
○ 薬事法等の一部を改正する法律(平成 25 年法律第 84 号)による医薬品、医療機器等の
品質、有効性及び安全性の確保等に関する法律(昭和 35 年法律第 145 号。以下「法」と
いう。)の施行に伴い、医療機器プログラムが新設され、プログラムを用いた医療機器に
おける基本要件基準についても改正されたところである(平成 26 年厚生労働省告示第 403
号)。
○ 今般、令和2年3月に国際医療機器規制当局フォーラム(IMDRF)において、
「医療機器
サイバーセキュリティの原則及び実践に関するガイダンス」が取りまとめられたことに伴
い、そのガイダンスの一部の文書(IMDRF N47 及び N60 文書)の内容を踏まえたプログラ
ムを用いた医療機器における基本要件基準の改正を行う。
2 改正の内容
○ IMDRF ガイダンスにおいて取りまとめられたサイバーセキュリティを確保するための
要件として、
① 製品の全ライフサイクルに渡って医療機器サイバーセキュリティを検討する計画を
備えること
② サイバーリスクを低減する設計及び製造を備えること
③ 適切な動作環境に必要となるハードウェア、ネットワーク、IT セキュリティ対策の最
低限の要件を設定すること
の3つの観点を基本要件基準に盛り込む改正を行う。
3
根拠規定
法第 41 条第3項
4 告示日等
告 示 日:令和5年2月下旬(予定)
適用期日:令和5年4月1日
1 / 19