よむ、つかう、まなぶ。
【資料1】基本要件基準の一部改正について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30272.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第9回 1/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
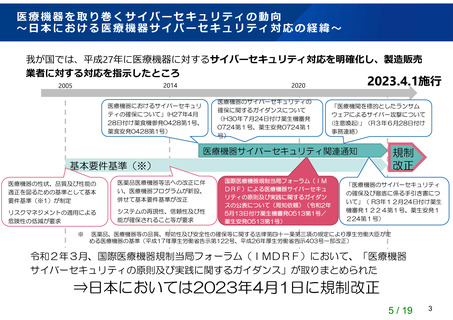
医療機器のサイバーセキュリティについて
~IMDRFガイダンスの国内導入に向けた検討状況~(令和4年12月時点)
国際
動向
IMDRF Guidance
Sub-Guidance WG (SBOM and Legacy device)
考え方を反映
AMED提言成果物
初版
(医療機関へ医療機器CS導入に向けた考え方を提言)(CS導入
AMED研究班調査活動
検討
体制
連携
医機連WG活動
(医機連TF活動による
医療業種との連携含む)
2021.12
医療機関における医療機器導入時のCS導入の考え方、等
の考え方)
注)CS:サイバーセキュリティ
製販業者向けガイダンス(手引書)にて技術基準等を明確化
初版
追補又は改正
追補又は改正
(CS対応の基
本的考え方※1)
SBoMの扱い
レガシー機器の扱い
(市販後安全対策、
等)
紐づけ
国内
運用
随時、追補等を実施
※1:企業におけるCS体制構築の考え方、等
関連法令・通知等
本格運用に向けた周知等
基本要件基準、「医療機器
のサイバーセキュリティの
確保に関するガイダンスに
ついて」(平成30年7月24日、
・IMDRFガイダンスに基づく本
格運用の開始を周知※2
・医機連ガイダンス等の幅広い周
知
薬生機審発0724第1号・薬生安発
0724第1号)等
2023.3発出
2022.秋
2023.3公布
IMDRFガイダンスに基づく国
内対応を本格的に運用
・基本要件基準改正(CSに関する要求事
項を明確化)
・関係通知を改訂、等※3
※3:国際ガイダンスの改訂に併せて都度更新
※2「医療機器のサイバーセキュリティの確保及び徹底に係る手引書について」
(令和3年12月24日薬生機審発1224第1号・薬生安発1224第1号)
6 / 19
2
~IMDRFガイダンスの国内導入に向けた検討状況~(令和4年12月時点)
国際
動向
IMDRF Guidance
Sub-Guidance WG (SBOM and Legacy device)
考え方を反映
AMED提言成果物
初版
(医療機関へ医療機器CS導入に向けた考え方を提言)(CS導入
AMED研究班調査活動
検討
体制
連携
医機連WG活動
(医機連TF活動による
医療業種との連携含む)
2021.12
医療機関における医療機器導入時のCS導入の考え方、等
の考え方)
注)CS:サイバーセキュリティ
製販業者向けガイダンス(手引書)にて技術基準等を明確化
初版
追補又は改正
追補又は改正
(CS対応の基
本的考え方※1)
SBoMの扱い
レガシー機器の扱い
(市販後安全対策、
等)
紐づけ
国内
運用
随時、追補等を実施
※1:企業におけるCS体制構築の考え方、等
関連法令・通知等
本格運用に向けた周知等
基本要件基準、「医療機器
のサイバーセキュリティの
確保に関するガイダンスに
ついて」(平成30年7月24日、
・IMDRFガイダンスに基づく本
格運用の開始を周知※2
・医機連ガイダンス等の幅広い周
知
薬生機審発0724第1号・薬生安発
0724第1号)等
2023.3発出
2022.秋
2023.3公布
IMDRFガイダンスに基づく国
内対応を本格的に運用
・基本要件基準改正(CSに関する要求事
項を明確化)
・関係通知を改訂、等※3
※3:国際ガイダンスの改訂に併せて都度更新
※2「医療機器のサイバーセキュリティの確保及び徹底に係る手引書について」
(令和3年12月24日薬生機審発1224第1号・薬生安発1224第1号)
6 / 19
2