よむ、つかう、まなぶ。
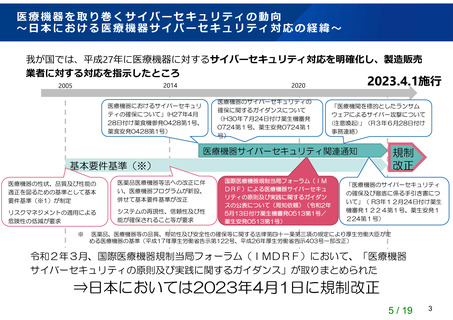
【資料1】基本要件基準の一部改正について (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30272.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第9回 1/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考条文)医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律
第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準
薬事法(昭和三十五年法律第百四十五号)第四十一条第三項の規定に基づき、薬事法第四十一条第三項の規定により厚生労働大臣が定める医療機器の基
準を次のように定め、平成十七年四月一日より適用する。
(設計)
第一条 医療機器(専ら動物のために使用されることが目的とされているものを除く。以下同じ。)は、当該医療機器の意図された使用条件及び用途に
従い、また、必要に応じ、技術知識及び経験を有し、並びに教育及び訓練を受けた意図された使用者によって適正に使用された場合において、患者の臨
床状態及び安全を損なわないよう、使用者(当該医療機器の使用に関して専門的知識を要する場合にあっては当該専門的知識を有する者に限る。以下同
じ。)及び第三者(当該医療機器の使用に当たって安全や健康に影響を受ける者に限る。第四条において同じ。)の安全や健康を害すことがないよう、
並びに使用の際に発生する危険性の程度が、その使用によって患者の得られる有用性に比して許容できる範囲内にあり、高水準の健康及び安全の確保が
可能なように設計及び製造されていなければならない。
(リスクマネジメント)
第二条 医療機器の設計及び製造に係る製造販売業者又は製造業者(以下「製造販売業者等」という。)は、最新の技術に立脚して医療機器の安全性を
確保しなければならない。危険性の低減が要求される場合、製造販売業者等は各危害についての残存する危険性が許容される範囲内にあると判断される
ように危険性を管理しなければならない。この場合において、製造販売業者等は次の各号に掲げる事項を当該各号の順序に従い、危険性の管理に適用し
なければならない。
一 既知又は予見し得る危害を識別し、意図された使用方法及び予測し得る誤使用に起因する危険性を評価すること。
二 前号により評価された危険性を本質的な安全設計及び製造を通じて、合理的に実行可能な限り除去すること。
三 前号に基づく危険性の除去を行った後に残存する危険性を適切な防護手段(警報装置を含む。)により、合理的に実行可能な限り低減すること。
四 第二号に基づく危険性の除去を行った後に残存する危険性を示すこと。
(医療機器の性能及び機能)
第三条 医療機器は、製造販売業者等の意図する性能を発揮できなければならず、医療機器としての機能を発揮できるよう設計及び製造されなければな
らない。
(製品の有効期間又は耐用期間)
第四条 製造販売業者等が設定した医療機器の製品の有効期間又は耐用期間内において当該医療機器が製造販売業者等の指示に従って、通常の使用条件
の下で発生しうる負荷を受け、かつ、製造販売業者等の指示に従って適切に保守された場合に、医療機器の特性及び性能は、患者、使用者及び第三者の
健康及び安全を脅かす有害な影響を与える程度に劣化等による悪影響を受けるものであってはならない。
13 / 19
10
第四十一条第三項の規定により厚生労働大臣が定める医療機器の基準
薬事法(昭和三十五年法律第百四十五号)第四十一条第三項の規定に基づき、薬事法第四十一条第三項の規定により厚生労働大臣が定める医療機器の基
準を次のように定め、平成十七年四月一日より適用する。
(設計)
第一条 医療機器(専ら動物のために使用されることが目的とされているものを除く。以下同じ。)は、当該医療機器の意図された使用条件及び用途に
従い、また、必要に応じ、技術知識及び経験を有し、並びに教育及び訓練を受けた意図された使用者によって適正に使用された場合において、患者の臨
床状態及び安全を損なわないよう、使用者(当該医療機器の使用に関して専門的知識を要する場合にあっては当該専門的知識を有する者に限る。以下同
じ。)及び第三者(当該医療機器の使用に当たって安全や健康に影響を受ける者に限る。第四条において同じ。)の安全や健康を害すことがないよう、
並びに使用の際に発生する危険性の程度が、その使用によって患者の得られる有用性に比して許容できる範囲内にあり、高水準の健康及び安全の確保が
可能なように設計及び製造されていなければならない。
(リスクマネジメント)
第二条 医療機器の設計及び製造に係る製造販売業者又は製造業者(以下「製造販売業者等」という。)は、最新の技術に立脚して医療機器の安全性を
確保しなければならない。危険性の低減が要求される場合、製造販売業者等は各危害についての残存する危険性が許容される範囲内にあると判断される
ように危険性を管理しなければならない。この場合において、製造販売業者等は次の各号に掲げる事項を当該各号の順序に従い、危険性の管理に適用し
なければならない。
一 既知又は予見し得る危害を識別し、意図された使用方法及び予測し得る誤使用に起因する危険性を評価すること。
二 前号により評価された危険性を本質的な安全設計及び製造を通じて、合理的に実行可能な限り除去すること。
三 前号に基づく危険性の除去を行った後に残存する危険性を適切な防護手段(警報装置を含む。)により、合理的に実行可能な限り低減すること。
四 第二号に基づく危険性の除去を行った後に残存する危険性を示すこと。
(医療機器の性能及び機能)
第三条 医療機器は、製造販売業者等の意図する性能を発揮できなければならず、医療機器としての機能を発揮できるよう設計及び製造されなければな
らない。
(製品の有効期間又は耐用期間)
第四条 製造販売業者等が設定した医療機器の製品の有効期間又は耐用期間内において当該医療機器が製造販売業者等の指示に従って、通常の使用条件
の下で発生しうる負荷を受け、かつ、製造販売業者等の指示に従って適切に保守された場合に、医療機器の特性及び性能は、患者、使用者及び第三者の
健康及び安全を脅かす有害な影響を与える程度に劣化等による悪影響を受けるものであってはならない。
13 / 19
10