よむ、つかう、まなぶ。
総-3-2○最適使用推進ガイドラインについて (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00177.html |
| 出典情報 | 中央社会保険医療協議会 総会(第540回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
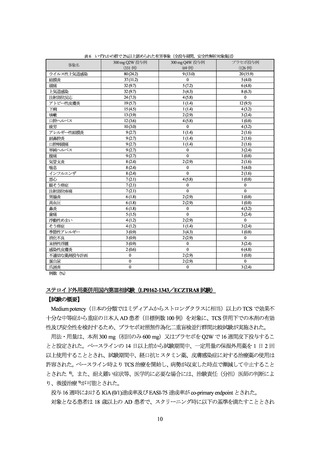
表 4 有効性の主要評価項目の成績(FAS、NRI)
300 mg Q2W 群
プラセボ群
投与 16 週時における IGA (0/1)達成率
38.9 (98/252)
26.2 (33/126)
プラセボ群との差[95%信頼区間]a)
12.4 [2.9, 21.9]
0.015
p 値 b)
投与 16 週時における EASI-75 達成率
56.0 (141/252)
35.7 (45/126)
プラセボ群との差[95%信頼区間]a)
20.2 [9.8, 30.6]
<0.001
p 値 b)
%(例数)
、救援治療を受けた被験者はノンレスポンダーとされた。
a) 地域(欧州/北米)とベースライン時の疾患重症度(IGA スコア 3 又は 4)を層別因子とした Mantel-Haenszel 法
b) 有意水準両側 5%、地域(欧州/北米)とベースライン時の疾患重症度(IGA スコア 3 又は 4)を層別因子とした Cochran-MantelHaenszel 検定
また、投与 16 週時に IGA (0/1)又は EASI-75 を達成した被験者に 32 週まで本剤 300 mg の Q2W 若
しくは Q4W 又はプラセボの Q2W 投与を行った際の、投与 32 週時の IGA (0/1)又は EASI-75 達成が
維持できた被験者の割合は表 5 のとおりであった。
表 5 長期投与時(投与 32 週時)の有効性(FAS)
300 mg Q2W 投与例 a)
300 mg Q4W 投与例 a)
IGA (0/1)達成率 EASI-75 達成率 IGA (0/1)達成率 EASI-75 達成率
89.6 (43/48)
92.5 (62/67)
77.6 (38/49)
90.8 (59/65)
プラセボ投与例 b)
IGA (0/1)達成率 EASI-75 達成率
60.6 (20/33)
77.5 (31/40)
ECZTRA3 試験
%(例数)
a) 初期投与期間の本剤群で投与 16 週時に IGA (0/1)又は EASI-75 を達成し、以降、本剤を Q2W 又は Q4W で投与された被験者
b) 初期投与期間のプラセボ群で投与 16 週時に IGA (0/1)又は EASI-75 を達成し、以降、プラセボを投与された被験者
(安全性)
全投与期間における有害事象は、300 mg Q2W 投与例 77.0%(255/331 例)
、300 mg Q4W 投与例
59.4%(41/69 例)
、プラセボ投与例 76.2%(96/126 例)に認められ10)、主な事象は表 6 のとおりであ
った。
死亡は認められなかった。
重篤な有害事象は 300 mg Q2W 投与例 2.1%(7/331 例〔虫垂炎、クロストリジウム菌性胃腸炎/
低血糖、靭帯断裂、胃十二指腸炎、手首関節骨折、うつ病、アナフィラキシー反応各 1 例〕
)
、プラ
セボ投与例 4.0%(5/126 例〔浸潤性乳管癌、帯状疱疹、気管支痙攣、感染性皮膚炎、無菌性髄膜炎
各 1 例)に認められ、300 mg Q2W 投与例 1 例(クロストリジウム菌性胃腸炎)については治験薬
との因果関係は否定されなかった。
投与中止に至った有害事象は、300 mg Q2W 投与例 2.7%(9/331 例)
、300 mg Q4W 投与例 1.4%
(1/69 例)
、プラセボ投与例 1.6%(2/126 例)に認められた。
副作用は 300 mg Q2W 投与例 47.4%(157/331 例)
、300 mg Q4W 投与例 23.2%(16/69 例)
、プラセ
ボ投与例 30.2%(38/126 例)に認められた。
10)
各有害事象は、有害事象発現直前に投与された治験薬によるものとして集計された。各投与例の定義は次のとおり。300 mg Q2W 投
与例:初期投与期間の 300 mg Q2W 群の被験者及び維持投与期間の 300 mg Q2W 投与群の被験者、300 mg Q4W 投与例:維持投与
期間の 300 mg Q4W 群の被験者、プラセボ投与例:初期投与期間のプラセボ群の被験者及び維持投与期間のプラセボ群の被験者
9
300 mg Q2W 群
プラセボ群
投与 16 週時における IGA (0/1)達成率
38.9 (98/252)
26.2 (33/126)
プラセボ群との差[95%信頼区間]a)
12.4 [2.9, 21.9]
0.015
p 値 b)
投与 16 週時における EASI-75 達成率
56.0 (141/252)
35.7 (45/126)
プラセボ群との差[95%信頼区間]a)
20.2 [9.8, 30.6]
<0.001
p 値 b)
%(例数)
、救援治療を受けた被験者はノンレスポンダーとされた。
a) 地域(欧州/北米)とベースライン時の疾患重症度(IGA スコア 3 又は 4)を層別因子とした Mantel-Haenszel 法
b) 有意水準両側 5%、地域(欧州/北米)とベースライン時の疾患重症度(IGA スコア 3 又は 4)を層別因子とした Cochran-MantelHaenszel 検定
また、投与 16 週時に IGA (0/1)又は EASI-75 を達成した被験者に 32 週まで本剤 300 mg の Q2W 若
しくは Q4W 又はプラセボの Q2W 投与を行った際の、投与 32 週時の IGA (0/1)又は EASI-75 達成が
維持できた被験者の割合は表 5 のとおりであった。
表 5 長期投与時(投与 32 週時)の有効性(FAS)
300 mg Q2W 投与例 a)
300 mg Q4W 投与例 a)
IGA (0/1)達成率 EASI-75 達成率 IGA (0/1)達成率 EASI-75 達成率
89.6 (43/48)
92.5 (62/67)
77.6 (38/49)
90.8 (59/65)
プラセボ投与例 b)
IGA (0/1)達成率 EASI-75 達成率
60.6 (20/33)
77.5 (31/40)
ECZTRA3 試験
%(例数)
a) 初期投与期間の本剤群で投与 16 週時に IGA (0/1)又は EASI-75 を達成し、以降、本剤を Q2W 又は Q4W で投与された被験者
b) 初期投与期間のプラセボ群で投与 16 週時に IGA (0/1)又は EASI-75 を達成し、以降、プラセボを投与された被験者
(安全性)
全投与期間における有害事象は、300 mg Q2W 投与例 77.0%(255/331 例)
、300 mg Q4W 投与例
59.4%(41/69 例)
、プラセボ投与例 76.2%(96/126 例)に認められ10)、主な事象は表 6 のとおりであ
った。
死亡は認められなかった。
重篤な有害事象は 300 mg Q2W 投与例 2.1%(7/331 例〔虫垂炎、クロストリジウム菌性胃腸炎/
低血糖、靭帯断裂、胃十二指腸炎、手首関節骨折、うつ病、アナフィラキシー反応各 1 例〕
)
、プラ
セボ投与例 4.0%(5/126 例〔浸潤性乳管癌、帯状疱疹、気管支痙攣、感染性皮膚炎、無菌性髄膜炎
各 1 例)に認められ、300 mg Q2W 投与例 1 例(クロストリジウム菌性胃腸炎)については治験薬
との因果関係は否定されなかった。
投与中止に至った有害事象は、300 mg Q2W 投与例 2.7%(9/331 例)
、300 mg Q4W 投与例 1.4%
(1/69 例)
、プラセボ投与例 1.6%(2/126 例)に認められた。
副作用は 300 mg Q2W 投与例 47.4%(157/331 例)
、300 mg Q4W 投与例 23.2%(16/69 例)
、プラセ
ボ投与例 30.2%(38/126 例)に認められた。
10)
各有害事象は、有害事象発現直前に投与された治験薬によるものとして集計された。各投与例の定義は次のとおり。300 mg Q2W 投
与例:初期投与期間の 300 mg Q2W 群の被験者及び維持投与期間の 300 mg Q2W 投与群の被験者、300 mg Q4W 投与例:維持投与
期間の 300 mg Q4W 群の被験者、プラセボ投与例:初期投与期間のプラセボ群の被験者及び維持投与期間のプラセボ群の被験者
9