よむ、つかう、まなぶ。
総-3-2○最適使用推進ガイドラインについて (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00177.html |
| 出典情報 | 中央社会保険医療協議会 総会(第540回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
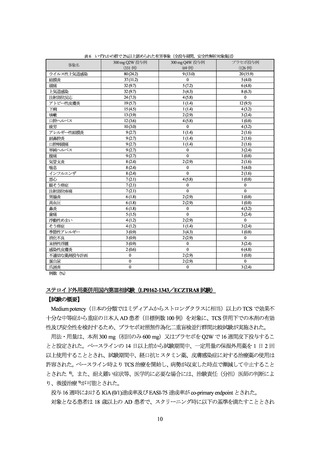
表 6 いずれかの群で 2%以上認められた有害事象(全投与期間、安全性解析対象集団)
300 mg Q2W 投与例
300 mg Q4W 投与例
プラセボ投与例
事象名
(331 例)
(69 例)
(126 例)
80 (24.2)
9 (13.0)
20 (15.9)
ウイルス性上気道感染
37 (11.2)
0
5 (4.0)
結膜炎
32 (9.7)
5 (7.2)
6 (4.8)
頭痛
32 (9.7)
3 (4.3)
8 (6.3)
上気道感染
24 (7.3)
4 (5.8)
0
注射部位反応
19 (5.7)
1 (1.4)
12 (9.5)
アトピー性皮膚炎
15 (4.5)
1 (1.4)
4 (3.2)
下痢
13 (3.9)
2 (2.9)
3 (2.4)
咳嗽
12 (3.6)
4 (5.8)
1 (0.8)
口腔ヘルペス
10 (3.0)
0
4 (3.2)
疲労
9 (2.7)
1 (1.4)
2 (1.6)
アレルギー性結膜炎
9 (2.7)
1 (1.4)
2 (1.6)
副鼻腔炎
9 (2.7)
1 (1.4)
2 (1.6)
口腔咽頭痛
9 (2.7)
0
3 (2.4)
単純ヘルペス
9 (2.7)
0
1 (0.8)
腹痛
8 (2.4)
2 (2.9)
2 (1.6)
気管支炎
8 (2.4)
0
5 (4.0)
喘息
8 (2.4)
0
2 (1.6)
インフルエンザ
7 (2.1)
4 (5.8)
1 (0.8)
悪心
7 (2.1)
0
0
眼そう痒症
7 (2.1)
0
0
注射部位疼痛
6 (1.8)
2 (2.9)
1 (0.8)
胃腸炎
6 (1.8)
2 (2.9)
1 (0.8)
高血圧
6 (1.8)
0
4 (3.2)
鼻炎
5 (1.5)
0
3 (2.4)
歯痛
4 (1.2)
2 (2.9)
0
浮動性めまい
4 (1.2)
1 (1.4)
3 (2.4)
そう痒症
3 (0.9)
3 (4.3)
1 (0.8)
季節性アレルギー
3 (0.9)
2 (2.9)
0
消化不良
3 (0.9)
0
3 (2.4)
末梢性浮腫
2 (0.6)
0
6 (4.8)
感染性皮膚炎
0
2 (2.9)
1 (0.8)
不適切な薬剤投与計画
0
2 (2.9)
0
蛋白尿
0
0
3 (2.4)
爪囲炎
例数(%)
ステロイド外用薬併用国内第Ⅲ相試験(LP0162-1343/ECZTRA8 試験)
【試験の概要】
Medium potency(日本の分類ではミディアムからストロングクラスに相当)以上の TCS で効果不
十分な中等症から重症の日本人 AD 患者(目標例数 100 例)を対象に、TCS 併用下での本剤の有効
性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試験が実施された。
用法・用量は、本剤 300 mg(初回のみ 600 mg)又はプラセボを Q2W で 16 週間皮下投与するこ
とと設定された。ベースラインの 14 日以上前から試験期間中、一定用量の保湿外用薬を 1 日 2 回
以上使用することとされ、試験期間中、経口抗ヒスタミン薬、皮膚感染症に対する治療薬の使用は
許容された。ベースライン時より TCS 治療を開始し、病勢が収束した時点で漸減して中止すること
とされた 8)。また、耐え難い症状等、医学的に必要な場合には、治験責任(分担)医師の判断によ
り、救援治療 9)が可能とされた。
投与 16 週時における IGA (0/1)達成率及び EASI-75 達成率が co-primary endpoint とされた。
対象となる患者は 18 歳以上の AD 患者で、スクリーニング時に以下の基準を満たすこととされ
10
300 mg Q2W 投与例
300 mg Q4W 投与例
プラセボ投与例
事象名
(331 例)
(69 例)
(126 例)
80 (24.2)
9 (13.0)
20 (15.9)
ウイルス性上気道感染
37 (11.2)
0
5 (4.0)
結膜炎
32 (9.7)
5 (7.2)
6 (4.8)
頭痛
32 (9.7)
3 (4.3)
8 (6.3)
上気道感染
24 (7.3)
4 (5.8)
0
注射部位反応
19 (5.7)
1 (1.4)
12 (9.5)
アトピー性皮膚炎
15 (4.5)
1 (1.4)
4 (3.2)
下痢
13 (3.9)
2 (2.9)
3 (2.4)
咳嗽
12 (3.6)
4 (5.8)
1 (0.8)
口腔ヘルペス
10 (3.0)
0
4 (3.2)
疲労
9 (2.7)
1 (1.4)
2 (1.6)
アレルギー性結膜炎
9 (2.7)
1 (1.4)
2 (1.6)
副鼻腔炎
9 (2.7)
1 (1.4)
2 (1.6)
口腔咽頭痛
9 (2.7)
0
3 (2.4)
単純ヘルペス
9 (2.7)
0
1 (0.8)
腹痛
8 (2.4)
2 (2.9)
2 (1.6)
気管支炎
8 (2.4)
0
5 (4.0)
喘息
8 (2.4)
0
2 (1.6)
インフルエンザ
7 (2.1)
4 (5.8)
1 (0.8)
悪心
7 (2.1)
0
0
眼そう痒症
7 (2.1)
0
0
注射部位疼痛
6 (1.8)
2 (2.9)
1 (0.8)
胃腸炎
6 (1.8)
2 (2.9)
1 (0.8)
高血圧
6 (1.8)
0
4 (3.2)
鼻炎
5 (1.5)
0
3 (2.4)
歯痛
4 (1.2)
2 (2.9)
0
浮動性めまい
4 (1.2)
1 (1.4)
3 (2.4)
そう痒症
3 (0.9)
3 (4.3)
1 (0.8)
季節性アレルギー
3 (0.9)
2 (2.9)
0
消化不良
3 (0.9)
0
3 (2.4)
末梢性浮腫
2 (0.6)
0
6 (4.8)
感染性皮膚炎
0
2 (2.9)
1 (0.8)
不適切な薬剤投与計画
0
2 (2.9)
0
蛋白尿
0
0
3 (2.4)
爪囲炎
例数(%)
ステロイド外用薬併用国内第Ⅲ相試験(LP0162-1343/ECZTRA8 試験)
【試験の概要】
Medium potency(日本の分類ではミディアムからストロングクラスに相当)以上の TCS で効果不
十分な中等症から重症の日本人 AD 患者(目標例数 100 例)を対象に、TCS 併用下での本剤の有効
性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試験が実施された。
用法・用量は、本剤 300 mg(初回のみ 600 mg)又はプラセボを Q2W で 16 週間皮下投与するこ
とと設定された。ベースラインの 14 日以上前から試験期間中、一定用量の保湿外用薬を 1 日 2 回
以上使用することとされ、試験期間中、経口抗ヒスタミン薬、皮膚感染症に対する治療薬の使用は
許容された。ベースライン時より TCS 治療を開始し、病勢が収束した時点で漸減して中止すること
とされた 8)。また、耐え難い症状等、医学的に必要な場合には、治験責任(分担)医師の判断によ
り、救援治療 9)が可能とされた。
投与 16 週時における IGA (0/1)達成率及び EASI-75 達成率が co-primary endpoint とされた。
対象となる患者は 18 歳以上の AD 患者で、スクリーニング時に以下の基準を満たすこととされ
10