よむ、つかう、まなぶ。
総-3-2○最適使用推進ガイドラインについて (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00177.html |
| 出典情報 | 中央社会保険医療協議会 総会(第540回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
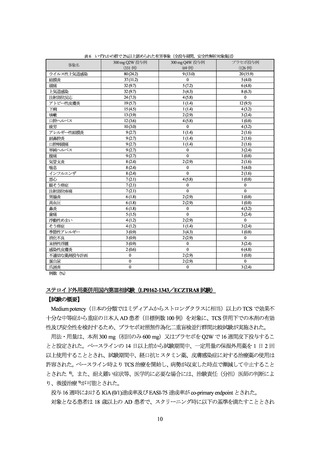
3.臨床成績
既存治療で効果不十分な AD の承認時に評価を行った主な臨床試験の成績を示す。
単独投与国際共同第Ⅲ相試験(LP0162-1325/ECZTRA1 試験)
【試験の概要】
Medium potency(日本の分類ではミディアムからストロングクラスに相当)以上のステロイド外
用薬(以下、
「TCS」
)で効果不十分又は安全性上の理由等から外用療法が推奨されない中等症から
重症の AD 患者(目標例数 780 例〔300 mg Q2W 群 585 例、プラセボ群 195 例〕
)を対象に、プラセ
ボに対する本剤単独投与の優越性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行
群間比較試験が日本、ドイツ、米国等の 5 の国又は地域で実施された。
本試験は、初期投与期間(投与 0~16 週)及び維持投与期間(投与 16~52 週)より構成された。
初期投与期間の用法・用量は、本剤 300 mg(初回のみ 600 mg)又はプラセボを 2 週に 1 回(Q2W)
で 16 週間皮下投与することと設定された。維持投与期間の用法・用量は、初期投与期間において
300 mg Q2W 投与群に割り付けられ、投与 16 週時に IGA (0/1)又は EASI-75 を達成した被験者は、盲
検下で 300 mg Q2W 群、300 mg Q4W 群又はプラセボ群に 2:2:1 で再度無作為割り付けされ1)、52
週まで本剤 300 mg を Q2W 若しくは Q4W 又はプラセボを Q2W で投与することとされた。初期投
与期間において、プラセボ群に割り付けられ、投与 16 週時に IGA (0/1)又は EASI-75 を達成した被
験者は、盲検下でプラセボを Q2W で引き続き投与することとされた。投与 16 週時に IGA (0/1)及び
EASI-75 を達成しなかった被験者並びに維持投与期間中に非盲検投与への移行基準2)を満たした被
験者は、非盲検下で投与 52 週まで本剤 300 mg を Q2W(必要に応じて TCS を使用)で投与するこ
ととされた3), 4)。
ベースラインの 14 日以上前から試験期間中一定用量の保湿外用薬を 1 日 2 回以上使用すること
とされた。試験期間中、経口抗ヒスタミン薬、皮膚感染症に対する治療薬の使用は許容されたが、
その他の AD に対する治療薬の併用は禁止され、耐え難い症状等、医学的に必要な場合には、治験
責任(分担)医師の判断により、救援治療5)が可能とされた。
投与 16 週時における医師による全般評価スコア(以下、
「IGA スコア」
)が 1 以下かつベースラ
インから 2 以上減少した被験者の割合(以下、
「IGA (0/1)達成率」
)及び全身の皮膚症状をスコア化
した EASI スコアがベースラインから 75%以上改善した被験者の割合(以下、
「EASI-75 達成率」
)
が co-primary endpoint とされた。
1)
2)
3)
4)
5)
地域(北米/日本/欧州)及び投与 16 週時の疾患重症度(IGA スコア 0/1 又は IGA スコア 1 超)が層別因子とされた。
非盲検投与への移行基準は次のいずれかを満たす場合とされた。①投与 16 週時に IGA スコア 0 であった被験者が維持投与期間中
に少なくとも 4 週間にわたり IGA スコア 2 以上かつ EASI-75 未達成であった場合、②投与 16 週時に IGA スコア 1 であった被験者
が維持投与期間中に少なくとも 4 週間にわたり IGA スコア 3 以上かつ EASI-75 未達成であった場合、③投与 16 週時に IGA スコア
1 超であった被験者が維持投与期間中に少なくとも 4 週間にわたり EASI-75 未達成であった場合。
必要に応じて、病変部位に対して mild 又は moderate strength の TCS(日本の分類ではミディアムからストロングクラスに相当)又
は外用カルシニューリン阻害薬(以下、
「TCI」
)の使用が許容された。
投与 16 週時に IGA (0/1)及び EASI-75 を達成しなかった日本人被験者のみ、維持投与期間終了後さらに 16 週間(68 週まで)本剤投
与を継続することとされた。
救援治療として、可能な限り外用薬治療のみを使用するよう努め、少なくとも 14 日間の外用薬治療を経て十分な反応が認められな
い被験者のみ全身治療を行うこととされた。被験者が全身性コルチコステロイド又は全身性非ステロイド性免疫抑制薬(シクロス
ポリン、メトトレキサート、ミコフェノール酸モフェチル、アザチオプリン等)による救援治療を受ける場合、治験薬投与は直ちに
中止することとされた。全身治療薬の最終投与から少なくとも 5 半減期が経過後、治験薬投与の再開が可能とされた。
4
既存治療で効果不十分な AD の承認時に評価を行った主な臨床試験の成績を示す。
単独投与国際共同第Ⅲ相試験(LP0162-1325/ECZTRA1 試験)
【試験の概要】
Medium potency(日本の分類ではミディアムからストロングクラスに相当)以上のステロイド外
用薬(以下、
「TCS」
)で効果不十分又は安全性上の理由等から外用療法が推奨されない中等症から
重症の AD 患者(目標例数 780 例〔300 mg Q2W 群 585 例、プラセボ群 195 例〕
)を対象に、プラセ
ボに対する本剤単独投与の優越性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行
群間比較試験が日本、ドイツ、米国等の 5 の国又は地域で実施された。
本試験は、初期投与期間(投与 0~16 週)及び維持投与期間(投与 16~52 週)より構成された。
初期投与期間の用法・用量は、本剤 300 mg(初回のみ 600 mg)又はプラセボを 2 週に 1 回(Q2W)
で 16 週間皮下投与することと設定された。維持投与期間の用法・用量は、初期投与期間において
300 mg Q2W 投与群に割り付けられ、投与 16 週時に IGA (0/1)又は EASI-75 を達成した被験者は、盲
検下で 300 mg Q2W 群、300 mg Q4W 群又はプラセボ群に 2:2:1 で再度無作為割り付けされ1)、52
週まで本剤 300 mg を Q2W 若しくは Q4W 又はプラセボを Q2W で投与することとされた。初期投
与期間において、プラセボ群に割り付けられ、投与 16 週時に IGA (0/1)又は EASI-75 を達成した被
験者は、盲検下でプラセボを Q2W で引き続き投与することとされた。投与 16 週時に IGA (0/1)及び
EASI-75 を達成しなかった被験者並びに維持投与期間中に非盲検投与への移行基準2)を満たした被
験者は、非盲検下で投与 52 週まで本剤 300 mg を Q2W(必要に応じて TCS を使用)で投与するこ
ととされた3), 4)。
ベースラインの 14 日以上前から試験期間中一定用量の保湿外用薬を 1 日 2 回以上使用すること
とされた。試験期間中、経口抗ヒスタミン薬、皮膚感染症に対する治療薬の使用は許容されたが、
その他の AD に対する治療薬の併用は禁止され、耐え難い症状等、医学的に必要な場合には、治験
責任(分担)医師の判断により、救援治療5)が可能とされた。
投与 16 週時における医師による全般評価スコア(以下、
「IGA スコア」
)が 1 以下かつベースラ
インから 2 以上減少した被験者の割合(以下、
「IGA (0/1)達成率」
)及び全身の皮膚症状をスコア化
した EASI スコアがベースラインから 75%以上改善した被験者の割合(以下、
「EASI-75 達成率」
)
が co-primary endpoint とされた。
1)
2)
3)
4)
5)
地域(北米/日本/欧州)及び投与 16 週時の疾患重症度(IGA スコア 0/1 又は IGA スコア 1 超)が層別因子とされた。
非盲検投与への移行基準は次のいずれかを満たす場合とされた。①投与 16 週時に IGA スコア 0 であった被験者が維持投与期間中
に少なくとも 4 週間にわたり IGA スコア 2 以上かつ EASI-75 未達成であった場合、②投与 16 週時に IGA スコア 1 であった被験者
が維持投与期間中に少なくとも 4 週間にわたり IGA スコア 3 以上かつ EASI-75 未達成であった場合、③投与 16 週時に IGA スコア
1 超であった被験者が維持投与期間中に少なくとも 4 週間にわたり EASI-75 未達成であった場合。
必要に応じて、病変部位に対して mild 又は moderate strength の TCS(日本の分類ではミディアムからストロングクラスに相当)又
は外用カルシニューリン阻害薬(以下、
「TCI」
)の使用が許容された。
投与 16 週時に IGA (0/1)及び EASI-75 を達成しなかった日本人被験者のみ、維持投与期間終了後さらに 16 週間(68 週まで)本剤投
与を継続することとされた。
救援治療として、可能な限り外用薬治療のみを使用するよう努め、少なくとも 14 日間の外用薬治療を経て十分な反応が認められな
い被験者のみ全身治療を行うこととされた。被験者が全身性コルチコステロイド又は全身性非ステロイド性免疫抑制薬(シクロス
ポリン、メトトレキサート、ミコフェノール酸モフェチル、アザチオプリン等)による救援治療を受ける場合、治験薬投与は直ちに
中止することとされた。全身治療薬の最終投与から少なくとも 5 半減期が経過後、治験薬投与の再開が可能とされた。
4