よむ、つかう、まなぶ。
材-4○ 医療機器業界からの意見聴取について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212455_00033.html |
| 出典情報 | 中央社会保険医療協議会 保険医療材料専門部会(第121回 8/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
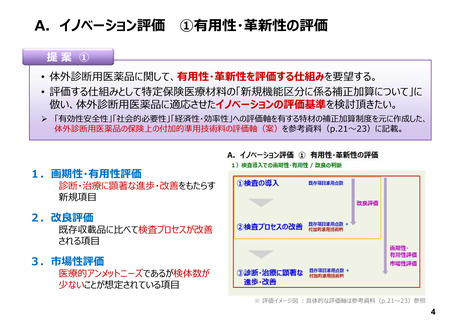
A.イノベーション評価
①有用性・革新性の評価
状況
• 体外診断用医薬品においては、保険適用希望書作成にあたり、「特定保険医療材料における基準
材料価格の算定における原価計算方式」の係数を用いて、「様式2-2:試薬の価格」に従い、積
み上げ方式にて点数計算を行っている。しかしながら、特定保険医療材料のような、画期性加算、有
用性加算、改良加算、市場性加算などの加算の仕組みがない。そのため、革新的な体外診断用医
薬品を開発しても現行のルールの中ではイノベーション評価がなされていない。
• 近年の科学技術の進歩に伴う患者や医療施設に貢献できる革新的な体外診断用医薬品を開発し
続けるための開発コストの確保、開発のインセンティブの予見性等が担保されないことから、次世代製
品開発のモチベーションが維持できない。
中医協資料 抜粋
課題
開発モチベーションを担保し、革新的な体外診
断用医薬品を早期に国内導入するためには、
臨床検査においても、革新性・有用性・市場性
評価をする必要がある
→ イノベーション評価システムの確立
3
①有用性・革新性の評価
状況
• 体外診断用医薬品においては、保険適用希望書作成にあたり、「特定保険医療材料における基準
材料価格の算定における原価計算方式」の係数を用いて、「様式2-2:試薬の価格」に従い、積
み上げ方式にて点数計算を行っている。しかしながら、特定保険医療材料のような、画期性加算、有
用性加算、改良加算、市場性加算などの加算の仕組みがない。そのため、革新的な体外診断用医
薬品を開発しても現行のルールの中ではイノベーション評価がなされていない。
• 近年の科学技術の進歩に伴う患者や医療施設に貢献できる革新的な体外診断用医薬品を開発し
続けるための開発コストの確保、開発のインセンティブの予見性等が担保されないことから、次世代製
品開発のモチベーションが維持できない。
中医協資料 抜粋
課題
開発モチベーションを担保し、革新的な体外診
断用医薬品を早期に国内導入するためには、
臨床検査においても、革新性・有用性・市場性
評価をする必要がある
→ イノベーション評価システムの確立
3