よむ、つかう、まなぶ。
別紙1 (23 ページ)
出典
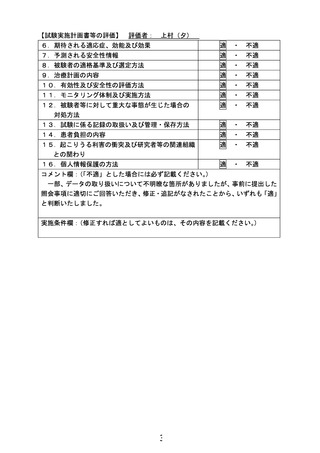
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
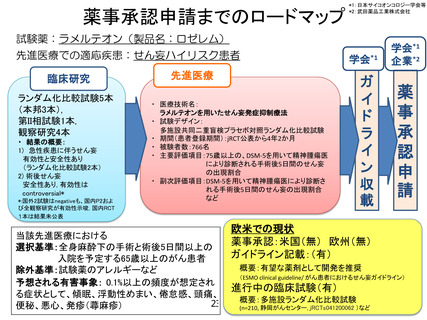
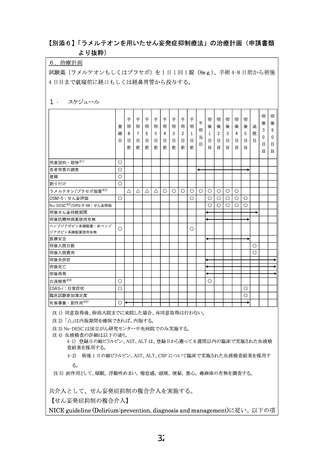
薬事承認申請までのロードマップ
*1:日本サイコオンコロジー学会等
*2:武田薬品工業株式会社
試験薬:ラメルテオン(製品名:ロゼレム)
先進医療での適応疾患:せん妄ハイリスク患者
臨床研究
ランダム化比較試験5本
(本邦3本),
第II相試験1本,
観察研究4本
・ 結果の概要:
1) 急性疾患に伴うせん妄
有効性と安全性あり
(ランダム化比較試験2本)
2) 術後せん妄
安全性あり, 有効性は
controversial*
*:国外2試験はnegativeも、国内P2およ
び全観察研究が有効性示唆, 国内RCT
1本は結果未公表
学会*1
先進医療
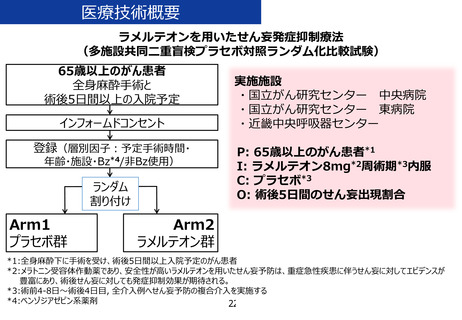
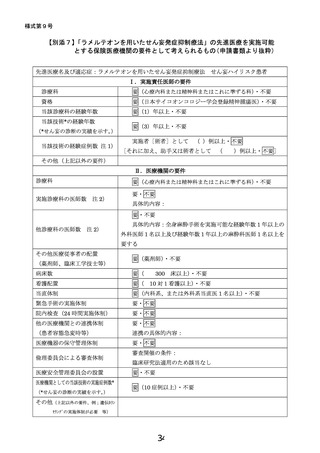
・ 医療技術名:
ラメルテオンを用いたせん妄発症抑制療法
・ 試験デザイン:
多施設共同二重盲検プラセボ対照ランダム化比較試験
・ 期間(患者登録期間):jRCT公表から4年2か月
・ 被験者数:766名
・ 主要評価項目:75歳以上の、DSM-5を用いて精神腫瘍医
により診断される手術後5日間のせん妄
の出現割合
・ 副次評価項目:DSM-5を用いて精神腫瘍医により診断さ
れる手術後5日間のせん妄の出現割合
など
当該先進医療における
選択基準:全身麻酔下の手術と術後5日間以上の
入院を予定する65歳以上のがん患者
除外基準:試験薬のアレルギーなど
予想される有害事象: 0.1%以上の頻度が想定され
る症状として、傾眠、浮動性めまい、倦怠感、頭痛、
23
便秘、悪心、発疹(蕁麻疹)
ガ
イ
ド
ラ
イ
ン
収
載
学会*1
企業*2
薬
事
承
認
申
請
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:(有)
概要:有望な薬剤として開発を推奨
(ESMO clinical guideline/ がん患者におけるせん妄ガイドライン)
進行中の臨床試験(有)
概要:多施設ランダム化比較試験
(n=210, 静岡がんセンター, jRCTs041200062 )など
*1:日本サイコオンコロジー学会等
*2:武田薬品工業株式会社
試験薬:ラメルテオン(製品名:ロゼレム)
先進医療での適応疾患:せん妄ハイリスク患者
臨床研究
ランダム化比較試験5本
(本邦3本),
第II相試験1本,
観察研究4本
・ 結果の概要:
1) 急性疾患に伴うせん妄
有効性と安全性あり
(ランダム化比較試験2本)
2) 術後せん妄
安全性あり, 有効性は
controversial*
*:国外2試験はnegativeも、国内P2およ
び全観察研究が有効性示唆, 国内RCT
1本は結果未公表
学会*1
先進医療
・ 医療技術名:
ラメルテオンを用いたせん妄発症抑制療法
・ 試験デザイン:
多施設共同二重盲検プラセボ対照ランダム化比較試験
・ 期間(患者登録期間):jRCT公表から4年2か月
・ 被験者数:766名
・ 主要評価項目:75歳以上の、DSM-5を用いて精神腫瘍医
により診断される手術後5日間のせん妄
の出現割合
・ 副次評価項目:DSM-5を用いて精神腫瘍医により診断さ
れる手術後5日間のせん妄の出現割合
など
当該先進医療における
選択基準:全身麻酔下の手術と術後5日間以上の
入院を予定する65歳以上のがん患者
除外基準:試験薬のアレルギーなど
予想される有害事象: 0.1%以上の頻度が想定され
る症状として、傾眠、浮動性めまい、倦怠感、頭痛、
23
便秘、悪心、発疹(蕁麻疹)
ガ
イ
ド
ラ
イ
ン
収
載
学会*1
企業*2
薬
事
承
認
申
請
欧米での現状
薬事承認:米国(無) 欧州(無)
ガイドライン記載:(有)
概要:有望な薬剤として開発を推奨
(ESMO clinical guideline/ がん患者におけるせん妄ガイドライン)
進行中の臨床試験(有)
概要:多施設ランダム化比較試験
(n=210, 静岡がんセンター, jRCTs041200062 )など