よむ、つかう、まなぶ。
別紙1 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24171.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第130回 3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
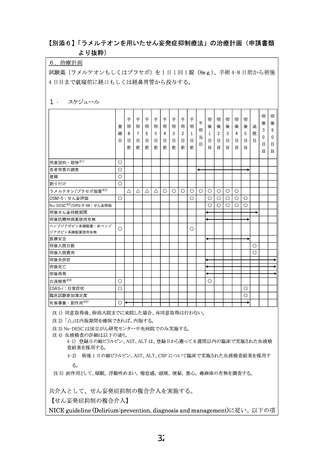
多要因がせん妄の発症率へ影響するが、既知のリスク因子を定式化し、介入群と対照
群のリスクを一定化する方法はない。がん患者の術式と術後せん妄リスクを検討した
メタアナリシスによれば、もっとも影響が大きい因子として、手術時間が挙げら
れる。手術時間は他の術中因子(失血量・輸液量・輸血・切除部位・創部再建・
リンパ節郭清・オピオイド使用)や術後因子(創感染)よりも高い術後せん妄の
オッズ比を示す(OR: 54.7(22.81-86.6))
。以上から、最も影響が大きい手術時間
を層別化因子に加え、さらに、術中因子でせん妄の発症に影響する可能性があ
る、麻酔方法や出血量・輸血の有無を、評価し、背景として介入群と対照群で差
が無いことを確認し、研究結果の一般化可能性を担保する。
・術後 2 日以内の薬剤再開が見込まれる患者を対象とする理由
75 歳以上の胃がんの高齢者を対象とした本邦の先行研究にて、手術後に休薬期間
を設け、術後 2 日目に内服を再開した場合に、ラメルテオンの術後せん妄発症抑制の有
効性が、安全性と共に示唆されており(19.文献情報 4)、試験薬の薬効評価のため、術
後 2 日以内の薬剤再開が見込まれる患者を対象とする。
除外基準
以下の項目の 1 つでも該当する症例は除外する。
1)
登録時に DSM-5(Diagnostic and Statistical Manual of Mental Disorders-5)でせん
妄と診断された患者
2)
ラメルテオンにアレルギーの既往のある患者
3)
以下のいずれかの基準に該当する、重度の肝機能障害を有する患者(AST > 90
U/L, ALT > 126 U/L (男性), ALT > 69 U/L (女性)、総ビリルビン > 2.25 mg/dL)
4)
登録日を含め、登録の 4 週間以内に新薬を用いた治験や臨床試験に参加していた
患者
5)
登録日を含め、登録の 2 週間以内にラメルテオンを内服している場合と、相互作用
が知られているフルボキサミンを内服している患者
6)
登録の 2 週間以内にオレキシン受容体拮抗薬(スボレキサント・レンボレキサント)を
内服している患者
7)
てんかん、パーキンソン病、またはレビー小体型認知症の病歴を有する患者
8)
乳糖不耐症の病歴を有する患者
9)
予定の切除範囲に中枢神経および頭蓋内を含む患者
10) 登録日を含め、登録の 5 年以内に薬物または、アルコール使用障害を有する患者、
毎日アルコールを平均 60g(例:日本酒 3 合、ビール中瓶 3 本、ワイン 5 杯)以上摂
取している患者、アルコール性疾患(アルコール性肝障害など)を有する患者
11) 本試験への参加歴のある患者
12) 中等度以上の認知症(MMSE-J < 21)の患者
13) 重度の視覚障害、聴覚障害、または読字障害のある患者
27
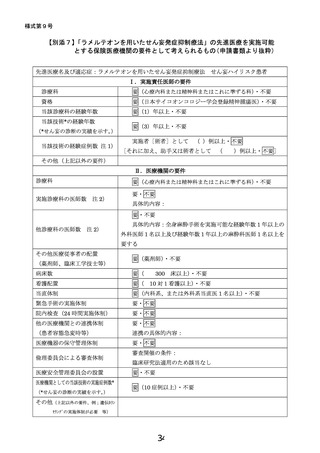
群のリスクを一定化する方法はない。がん患者の術式と術後せん妄リスクを検討した
メタアナリシスによれば、もっとも影響が大きい因子として、手術時間が挙げら
れる。手術時間は他の術中因子(失血量・輸液量・輸血・切除部位・創部再建・
リンパ節郭清・オピオイド使用)や術後因子(創感染)よりも高い術後せん妄の
オッズ比を示す(OR: 54.7(22.81-86.6))
。以上から、最も影響が大きい手術時間
を層別化因子に加え、さらに、術中因子でせん妄の発症に影響する可能性があ
る、麻酔方法や出血量・輸血の有無を、評価し、背景として介入群と対照群で差
が無いことを確認し、研究結果の一般化可能性を担保する。
・術後 2 日以内の薬剤再開が見込まれる患者を対象とする理由
75 歳以上の胃がんの高齢者を対象とした本邦の先行研究にて、手術後に休薬期間
を設け、術後 2 日目に内服を再開した場合に、ラメルテオンの術後せん妄発症抑制の有
効性が、安全性と共に示唆されており(19.文献情報 4)、試験薬の薬効評価のため、術
後 2 日以内の薬剤再開が見込まれる患者を対象とする。
除外基準
以下の項目の 1 つでも該当する症例は除外する。
1)
登録時に DSM-5(Diagnostic and Statistical Manual of Mental Disorders-5)でせん
妄と診断された患者
2)
ラメルテオンにアレルギーの既往のある患者
3)
以下のいずれかの基準に該当する、重度の肝機能障害を有する患者(AST > 90
U/L, ALT > 126 U/L (男性), ALT > 69 U/L (女性)、総ビリルビン > 2.25 mg/dL)
4)
登録日を含め、登録の 4 週間以内に新薬を用いた治験や臨床試験に参加していた
患者
5)
登録日を含め、登録の 2 週間以内にラメルテオンを内服している場合と、相互作用
が知られているフルボキサミンを内服している患者
6)
登録の 2 週間以内にオレキシン受容体拮抗薬(スボレキサント・レンボレキサント)を
内服している患者
7)
てんかん、パーキンソン病、またはレビー小体型認知症の病歴を有する患者
8)
乳糖不耐症の病歴を有する患者
9)
予定の切除範囲に中枢神経および頭蓋内を含む患者
10) 登録日を含め、登録の 5 年以内に薬物または、アルコール使用障害を有する患者、
毎日アルコールを平均 60g(例:日本酒 3 合、ビール中瓶 3 本、ワイン 5 杯)以上摂
取している患者、アルコール性疾患(アルコール性肝障害など)を有する患者
11) 本試験への参加歴のある患者
12) 中等度以上の認知症(MMSE-J < 21)の患者
13) 重度の視覚障害、聴覚障害、または読字障害のある患者
27