よむ、つかう、まなぶ。
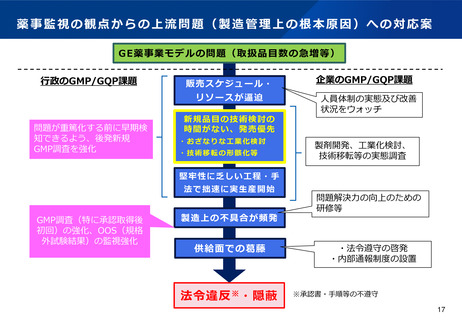
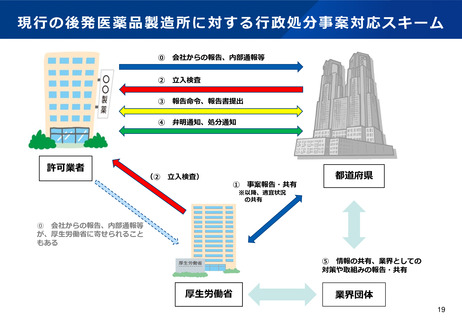
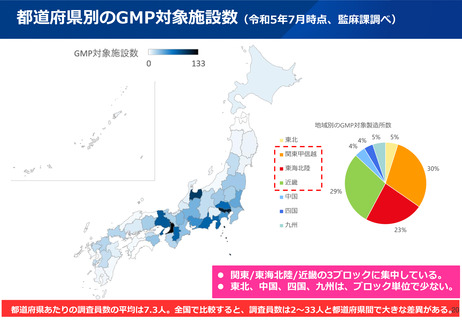
【資料2】有識者検討会の議論を踏まえた薬事監視の向上について (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
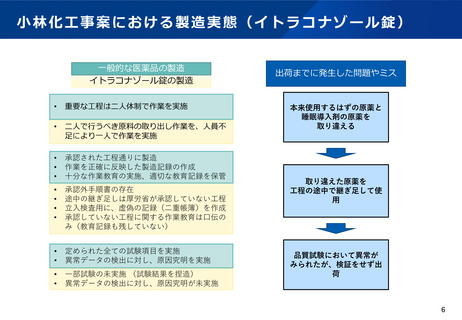
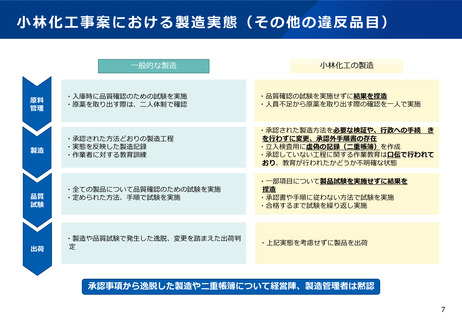
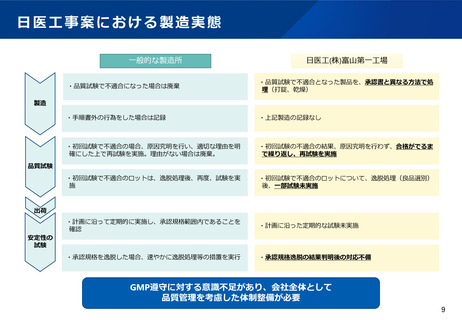
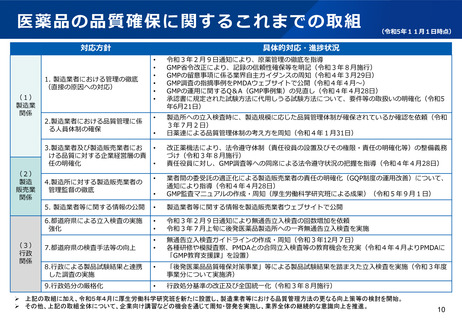
医薬品の品質確保に関するこれまでの取組
対応方針
令和3年2月9日通知により、原薬管理の徹底を指導
GMP省令改正により、記録の信頼性確保等を明記(令和3年8月施行)
GMPの留意事項に係る業界自主ガイダンスの周知(令和4年3月29日)
GMP調査の指摘事例をPMDAウェブサイトで公開(令和4年4月~)
GMPの運用に関するQ&A(GMP事例集)の見直し(令和4年4月28日)
承認書に規定された試験方法に代用しうる試験方法について、要件等の取扱いの明確化(令和5
年6月21日)
2.製造業者における品質管理に係
る人員体制の確保
•
製造所への立入検査時に、製造規模に応じた品質管理体制が確保されているか確認を依頼(令和
3年7月2日)
日薬連による品質管理体制の考え方を周知(令和4年1月31日)
3.製造業者及び製造販売業者にお
ける品質に対する企業経営層の責
任の明確化
•
4.製造所に対する製造販売業者の
管理監督の徹底
•
•
業者間の委受託の適正化による製造販売業者の責任の明確化(GQP制度の運用改善)について、
通知により指導(令和4年4月28日)
GMP監査マニュアルの作成・周知(厚生労働科学研究班による成果)(令和5年9月1日)
5. 製造業者等に関する情報の公開
•
製造業者等に関する情報を製造販売業者ウェブサイトで公開
6.都道府県による立入検査の実施
強化
•
•
令和3年2月9日通知により無通告立入検査の回数増加を依頼
令和3年7月上旬に後発医薬品製造所への一斉無通告立入検査を実施
7.都道府県の検査手法等の向上
•
•
無通告立入検査ガイドラインの作成・周知(令和3年12月7日)
各種研修や模擬査察、PMDAとの合同立入検査等の教育機会を充実(令和4年4月よりPMDAに
「GMP教育支援課」を設置)
8.行政による製品試験結果と連携
した調査の実施
•
「後発医薬品品質確保対策事業」等による製品試験結果を踏まえた立入検査を実施(令和3年度
事業分について実施済)
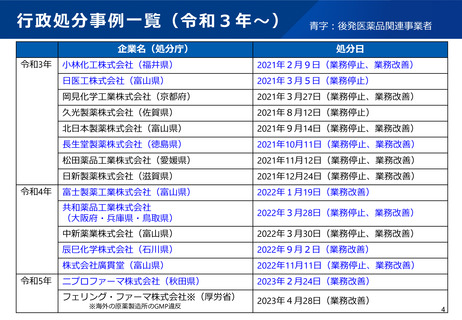
9.行政処分の厳格化
•
行政処分基準の改正及び全国統一化(令和3年8月施行)
(1)
製造業
関係
(3)
行政
関係
具体的対応・進捗状況
•
•
•
•
•
•
1. 製造業者における管理の徹底
(直接の原因への対応)
(2)
製造
販売業
関係
(令和5年11月1日時点)
•
•
改正薬機法により、法令遵守体制(責任役員の設置及びその権限・責任の明確化等)の整備義務
づけ(令和3年8月施行)
責任役員に対し、GMP調査等への同席による法令遵守状況の把握を指導(令和4年4月28日)
➢ 上記の取組に加え、令和5年4月に厚生労働科学研究班を新たに設置し、製造業者等における品質管理方法の更なる向上策等の検討を開始。
➢ その他、上記の取組全体について、企業向け講習などの機会を通じて周知・啓発を実施し、業界全体の継続的な意識向上を推進。
10
対応方針
令和3年2月9日通知により、原薬管理の徹底を指導
GMP省令改正により、記録の信頼性確保等を明記(令和3年8月施行)
GMPの留意事項に係る業界自主ガイダンスの周知(令和4年3月29日)
GMP調査の指摘事例をPMDAウェブサイトで公開(令和4年4月~)
GMPの運用に関するQ&A(GMP事例集)の見直し(令和4年4月28日)
承認書に規定された試験方法に代用しうる試験方法について、要件等の取扱いの明確化(令和5
年6月21日)
2.製造業者における品質管理に係
る人員体制の確保
•
製造所への立入検査時に、製造規模に応じた品質管理体制が確保されているか確認を依頼(令和
3年7月2日)
日薬連による品質管理体制の考え方を周知(令和4年1月31日)
3.製造業者及び製造販売業者にお
ける品質に対する企業経営層の責
任の明確化
•
4.製造所に対する製造販売業者の
管理監督の徹底
•
•
業者間の委受託の適正化による製造販売業者の責任の明確化(GQP制度の運用改善)について、
通知により指導(令和4年4月28日)
GMP監査マニュアルの作成・周知(厚生労働科学研究班による成果)(令和5年9月1日)
5. 製造業者等に関する情報の公開
•
製造業者等に関する情報を製造販売業者ウェブサイトで公開
6.都道府県による立入検査の実施
強化
•
•
令和3年2月9日通知により無通告立入検査の回数増加を依頼
令和3年7月上旬に後発医薬品製造所への一斉無通告立入検査を実施
7.都道府県の検査手法等の向上
•
•
無通告立入検査ガイドラインの作成・周知(令和3年12月7日)
各種研修や模擬査察、PMDAとの合同立入検査等の教育機会を充実(令和4年4月よりPMDAに
「GMP教育支援課」を設置)
8.行政による製品試験結果と連携
した調査の実施
•
「後発医薬品品質確保対策事業」等による製品試験結果を踏まえた立入検査を実施(令和3年度
事業分について実施済)
9.行政処分の厳格化
•
行政処分基準の改正及び全国統一化(令和3年8月施行)
(1)
製造業
関係
(3)
行政
関係
具体的対応・進捗状況
•
•
•
•
•
•
1. 製造業者における管理の徹底
(直接の原因への対応)
(2)
製造
販売業
関係
(令和5年11月1日時点)
•
•
改正薬機法により、法令遵守体制(責任役員の設置及びその権限・責任の明確化等)の整備義務
づけ(令和3年8月施行)
責任役員に対し、GMP調査等への同席による法令遵守状況の把握を指導(令和4年4月28日)
➢ 上記の取組に加え、令和5年4月に厚生労働科学研究班を新たに設置し、製造業者等における品質管理方法の更なる向上策等の検討を開始。
➢ その他、上記の取組全体について、企業向け講習などの機会を通じて周知・啓発を実施し、業界全体の継続的な意識向上を推進。
10