よむ、つかう、まなぶ。
【資料2】有識者検討会の議論を踏まえた薬事監視の向上について (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
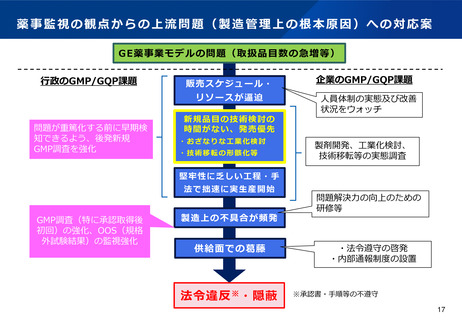
上流問題(製造開始時における製剤開発や工業化検討が不十分)
※行政処分企業の第三者調査委員会報告書より
A社
⚫
⚫
製造販売承認を取得し、実際の製造の準備を行う段になって、規格どおりの製品を製造することができない
事態が生じる場合があり、研究開発本部担当者と生産部門担当者が試行錯誤しながら、製造工程に改良を
加える必要が生じた。
承認が得られた段階で、発売日等が決定され、宣伝活動等も開始されるため、製造工程の改良に使うことの
できる時間は限られており、限られた時間で改良を検討する必要があったが、その過程で、承認書と齟齬す
る製造方法が採用されることになった。
B社
⚫
⚫
⚫
⚫
承認書・手順書と齟齬する製造方法が行われる要因として、当該品目の製造開始時における製剤開発や工業
化検討が不十分であり、手順書どおりに製造を行っても、工程管理値を満たさないことや、作業性が悪い
といった製造上の課題が生じていたという点も挙げられる。
製造方法や各種条件が品質に与える影響等についての基礎研究は充実して行われるようになっているが、
それ以前は、こうした基礎研究が十分に行われてこなかったとのことである。
また、必ずしも研究所が立ち合い等を行うことなく、工場の製造部門においてラボスケールからフルス
ケールへのスケールアップを行うなど、スケールアップの検討が不十分なものもあったとのことである。
製造開始時の製造方法(手順)の検討が不足していたことが、実際に製造を行う中で、製造現場において製
造方法を変更することを余儀なくされることにつながっていたものと考えられる。
C社
⚫
⚫
承認書や製品標準書どおりの製造方法では製造ができない品目が存在することから、開発当初の製剤設計や
製造方法の検討、また、開発部門から製造部門への技術移管が十分でないことが伺われる。
新製品の市場出荷が遅れることを避けなければならないという意識が強く、製剤開発や技術移管が不十分で
あっても、差し当たり設定した条件により製造が開始されることもあり、こうして製造及び出荷を行った品
目について、承認書や製品標準書との相違が生じているものと考えられる。
法令違反の上流にある共通の問題点として「拙速な技術開発・検討」の課題がある。
16
※行政処分企業の第三者調査委員会報告書より
A社
⚫
⚫
製造販売承認を取得し、実際の製造の準備を行う段になって、規格どおりの製品を製造することができない
事態が生じる場合があり、研究開発本部担当者と生産部門担当者が試行錯誤しながら、製造工程に改良を
加える必要が生じた。
承認が得られた段階で、発売日等が決定され、宣伝活動等も開始されるため、製造工程の改良に使うことの
できる時間は限られており、限られた時間で改良を検討する必要があったが、その過程で、承認書と齟齬す
る製造方法が採用されることになった。
B社
⚫
⚫
⚫
⚫
承認書・手順書と齟齬する製造方法が行われる要因として、当該品目の製造開始時における製剤開発や工業
化検討が不十分であり、手順書どおりに製造を行っても、工程管理値を満たさないことや、作業性が悪い
といった製造上の課題が生じていたという点も挙げられる。
製造方法や各種条件が品質に与える影響等についての基礎研究は充実して行われるようになっているが、
それ以前は、こうした基礎研究が十分に行われてこなかったとのことである。
また、必ずしも研究所が立ち合い等を行うことなく、工場の製造部門においてラボスケールからフルス
ケールへのスケールアップを行うなど、スケールアップの検討が不十分なものもあったとのことである。
製造開始時の製造方法(手順)の検討が不足していたことが、実際に製造を行う中で、製造現場において製
造方法を変更することを余儀なくされることにつながっていたものと考えられる。
C社
⚫
⚫
承認書や製品標準書どおりの製造方法では製造ができない品目が存在することから、開発当初の製剤設計や
製造方法の検討、また、開発部門から製造部門への技術移管が十分でないことが伺われる。
新製品の市場出荷が遅れることを避けなければならないという意識が強く、製剤開発や技術移管が不十分で
あっても、差し当たり設定した条件により製造が開始されることもあり、こうして製造及び出荷を行った品
目について、承認書や製品標準書との相違が生じているものと考えられる。
法令違反の上流にある共通の問題点として「拙速な技術開発・検討」の課題がある。
16