よむ、つかう、まなぶ。
【資料2】有識者検討会の議論を踏まえた薬事監視の向上について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36390.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第5回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
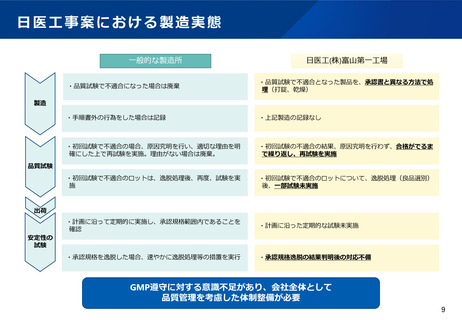
日医工事案における製造実態
一般的な製造所
日医工(株)富山第一工場
・品質試験で不適合になった場合は廃棄
・品質試験で不適合となった製品を、承認書と異なる方法で処
理(打錠、乾燥)
・手順書外の行為をした場合は記録
・手順書外の行為をした場合は記録
・上記製造の記録なし
・初回試験で不適合の場合、原因究明を行い、適切な理由を明
・初回試験で不適合の場合、原因究明を行い、適切な理由を明
確にした上で再試験を実施。理由がない場合は廃棄。
確にした上で再試験を実施。理由がない場合は廃棄。
・初回試験の不適合の結果、原因究明を行わず、合格がでるま
で繰り返し、再試験を実施
・初回試験で不適合のロットは、逸脱処理後、再度、試験を実
・初回試験で不適合のロットは、逸脱処理後、再度、試験を実
施
施
・初回試験で不適合のロットについて、逸脱処理(良品選別)
後、一部試験未実施
・計画に沿って定期的に実施し、承認規格範囲内であることを
・計画に沿って定期的に実施し、承認規格範囲内であることを
確認
確認
・計画に沿った定期的な試験未実施
・承認規格を逸脱した場合、速やかに逸脱処理等の措置を実行
・承認規格を逸脱した場合、速やかに逸脱処理等の措置を実行
・承認規格逸脱の結果判明後の対応不備
製造
品質試験
出荷
安定性の
試験
GMP遵守に対する意識不足があり、会社全体として
品質管理を考慮した体制整備が必要
9
一般的な製造所
日医工(株)富山第一工場
・品質試験で不適合になった場合は廃棄
・品質試験で不適合となった製品を、承認書と異なる方法で処
理(打錠、乾燥)
・手順書外の行為をした場合は記録
・手順書外の行為をした場合は記録
・上記製造の記録なし
・初回試験で不適合の場合、原因究明を行い、適切な理由を明
・初回試験で不適合の場合、原因究明を行い、適切な理由を明
確にした上で再試験を実施。理由がない場合は廃棄。
確にした上で再試験を実施。理由がない場合は廃棄。
・初回試験の不適合の結果、原因究明を行わず、合格がでるま
で繰り返し、再試験を実施
・初回試験で不適合のロットは、逸脱処理後、再度、試験を実
・初回試験で不適合のロットは、逸脱処理後、再度、試験を実
施
施
・初回試験で不適合のロットについて、逸脱処理(良品選別)
後、一部試験未実施
・計画に沿って定期的に実施し、承認規格範囲内であることを
・計画に沿って定期的に実施し、承認規格範囲内であることを
確認
確認
・計画に沿った定期的な試験未実施
・承認規格を逸脱した場合、速やかに逸脱処理等の措置を実行
・承認規格を逸脱した場合、速やかに逸脱処理等の措置を実行
・承認規格逸脱の結果判明後の対応不備
製造
品質試験
出荷
安定性の
試験
GMP遵守に対する意識不足があり、会社全体として
品質管理を考慮した体制整備が必要
9