よむ、つかう、まなぶ。
総-3-1○最適使用推進ガイドラインについて (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00251.html |
| 出典情報 | 中央社会保険医療協議会 総会(第587回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
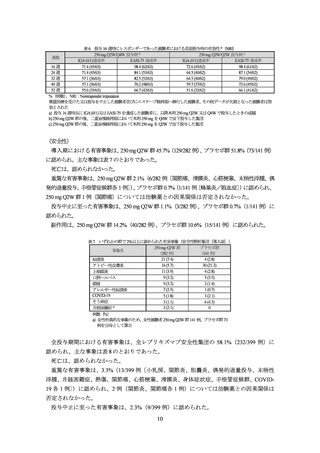
副作用は、20.8%(83/399 例)に認められた。
表 8 2%以上に認められた有害事象(全投与期間、全レブリキズマブ安全性集団)
本剤投与例
事象名
(399 例)
結膜炎
33 (8.3)
アトピー性皮膚炎
31 (7.8)
上咽頭炎
27 (6.8)
COVID-19
24 (6.0)
アレルギー性結膜炎
22 (5.5)
口腔ヘルペス
15 (3.8)
頭痛
13 (3.3)
月経困難症 a)
4 (2.0 )
例数(%)
a) 女性特異的な事象であるため、女性被験者 196 例を分母として算出
単独投与海外第Ⅲ相試験(KGAC 試験)
【試験の概要】
TCS 等の外用薬治療で効果不十分又は医学的に外用薬治療が推奨されない、中等症から重症の
AD 患者(目標例数 400 例〔本薬群とプラセボ群に 2:1 の割付比〕
)を対象に、プラセボに対する
本剤単独投与の優越性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試
験が米国、ドイツ、台湾等の 8 の国又は地域で実施された。
本試験は KGAB 試験と同一の試験デザインで実施された。
投与 16 週時における IGA (0/1)達成率及び EASI-75 達成率が co-primary endpoint とされた。
対象となる患者は、12 歳以上の AD 患者で、以下の基準を満たすこととされた。
(主な選択基準)
1 年以上前に American Academy of Dermatology Consensus Criteria に基づき AD と診断されてい
る
過去に外用薬治療で効果不十分又は外用薬治療が医学的に推奨されない
ベースライン時の AD による病変が体表面積の 10%以上、EASI スコアが 16 以上及び IGA ス
コアが 3 以上
12 歳以上 18 歳未満の場合は体重が 40 kg 以上
【結果】
(有効性)
有効性の co-primary endpoint である投与 16 週時における IGA (0/1)達成率及び EASI-75 達成率は表
9 のとおりであり、Modified intention to treat(mITT)集団7)のプラセボ群と 250 mg Q2W 群との対比
較において、いずれの評価項目についても統計学的に有意な差が認められ、プラセボに対する本剤
250 mg Q2W 投与の優越性が検証された。
7) 無作為化された 445 例(250 mg Q2W 群 295 例、プラセボ群 150 例)が ITT 集団とされたが、盲検解除後に監査にて 1 つの実施医療
機関においてベースライン時の AD 重症度の評価に関する Good Clinical Practice(以下、
「GCP」
)不遵守が特定されたことを受け、
統計解析計画書の改訂を行い、当該実施医療機関の被験者を除いた 427 例(250 mg Q2W 群 281 例、プラセボ群 146 例)を mITT 集
団とし、mITT 集団が有効性解析対象集団とされた。
11
表 8 2%以上に認められた有害事象(全投与期間、全レブリキズマブ安全性集団)
本剤投与例
事象名
(399 例)
結膜炎
33 (8.3)
アトピー性皮膚炎
31 (7.8)
上咽頭炎
27 (6.8)
COVID-19
24 (6.0)
アレルギー性結膜炎
22 (5.5)
口腔ヘルペス
15 (3.8)
頭痛
13 (3.3)
月経困難症 a)
4 (2.0 )
例数(%)
a) 女性特異的な事象であるため、女性被験者 196 例を分母として算出
単独投与海外第Ⅲ相試験(KGAC 試験)
【試験の概要】
TCS 等の外用薬治療で効果不十分又は医学的に外用薬治療が推奨されない、中等症から重症の
AD 患者(目標例数 400 例〔本薬群とプラセボ群に 2:1 の割付比〕
)を対象に、プラセボに対する
本剤単独投与の優越性及び安全性を検討するため、プラセボ対照無作為化二重盲検並行群間比較試
験が米国、ドイツ、台湾等の 8 の国又は地域で実施された。
本試験は KGAB 試験と同一の試験デザインで実施された。
投与 16 週時における IGA (0/1)達成率及び EASI-75 達成率が co-primary endpoint とされた。
対象となる患者は、12 歳以上の AD 患者で、以下の基準を満たすこととされた。
(主な選択基準)
1 年以上前に American Academy of Dermatology Consensus Criteria に基づき AD と診断されてい
る
過去に外用薬治療で効果不十分又は外用薬治療が医学的に推奨されない
ベースライン時の AD による病変が体表面積の 10%以上、EASI スコアが 16 以上及び IGA ス
コアが 3 以上
12 歳以上 18 歳未満の場合は体重が 40 kg 以上
【結果】
(有効性)
有効性の co-primary endpoint である投与 16 週時における IGA (0/1)達成率及び EASI-75 達成率は表
9 のとおりであり、Modified intention to treat(mITT)集団7)のプラセボ群と 250 mg Q2W 群との対比
較において、いずれの評価項目についても統計学的に有意な差が認められ、プラセボに対する本剤
250 mg Q2W 投与の優越性が検証された。
7) 無作為化された 445 例(250 mg Q2W 群 295 例、プラセボ群 150 例)が ITT 集団とされたが、盲検解除後に監査にて 1 つの実施医療
機関においてベースライン時の AD 重症度の評価に関する Good Clinical Practice(以下、
「GCP」
)不遵守が特定されたことを受け、
統計解析計画書の改訂を行い、当該実施医療機関の被験者を除いた 427 例(250 mg Q2W 群 281 例、プラセボ群 146 例)を mITT 集
団とし、mITT 集団が有効性解析対象集団とされた。
11