よむ、つかう、まなぶ。
総-3-1○最適使用推進ガイドラインについて (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00251.html |
| 出典情報 | 中央社会保険医療協議会 総会(第587回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
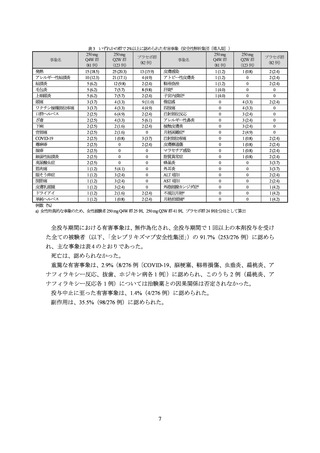
表 2 投与 16 週時に IGA (0/1)又は EASI-75 を達成した被験者における長期投与時の有効性(KGAL 試験、NRI)
投与 16 週時に IGA (0/1)を達成した被験者における
投与 16 週時に EASI-75 を達成した被験者における
IGA (0/1)達成を維持した被験者の割合
EASI-75 達成を維持した被験者の割合
週数
250 mg Q4W/Q4W
250 mg Q2W/Q4W
250 mg Q2W/Q2W
250 mg Q4W/Q4W
250 mg Q2W/Q4W
250 mg Q2W/Q2W
投与例 a)
投与例 b)
投与例 c)
投与例 a)
投与例 b)
投与例 c)
16 週
100 (23/23)
100 (16/16)
100 (24/24)
100 (38/38)
100 (33/33)
100 (29/29)
24 週
73.9 (17/23)
75.0 (12/16)
75.0 (18/24)
86.8 (33/38)
93.9 (31/33)
89.7 (26/29)
32 週
52.2 (12/23)
68.8 (11/16)
75.0 (18/24)
89.5 (34/38)
81.8 (27/33)
86.2 (25/29)
40 週
52.2 (12/23)
62.5 (10/16)
79.2 (19/24)
81.6 (31/38)
84.8 (28/33)
89.7 (26/29)
52 週
69.6 (16/23)
50.0 (8/16)
66.7 (16/24)
81.6 (31/38)
72.7 (24/33)
89.7 (26/29)
68 週
60.9 (14/23)
56.3 (9/16)
70.8 (17/24)
73.7 (28/38)
75.8 (25/33)
79.3 (23/29)
%(例数)
、NRI:Nonresponder imputation
救援治療を受けた又は投与を中止した被験者並びにエスケープ維持期へ移行した被験者、その他データが欠測となった被験者は無効とされ
た
a) 250 mg Q4W 群の後、二重盲検維持期において本剤 250 mg を Q4W で皮下投与した集団
b) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q4W で皮下投与した集団
c) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q2W で皮下投与した集団
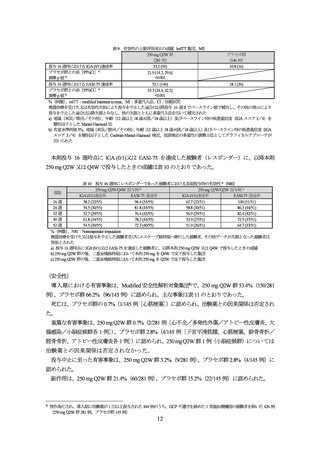
(安全性)
導入期における有害事象は、250 mg Q4W 群 60.5%(49/81 例)
、250 mg Q2W 群 75.6%(93/123 例)
、
プラセボ群 63.4%(52/82 例)に認められ、主な事象は表 3 のとおりであった。
死亡は、認められなかった。
重篤な有害事象は、250 mg Q2W 群 0.8%(1/123 例〔脳梗塞〕
)
、プラセボ群 2.4%(2/82 例〔COVID19、カンピロバクター胃腸炎各 1 例〕
)に認められたが、いずれも治験薬との因果関係は否定され
た。
投与中止に至った有害事象は、250 mg Q2W 群 1.6%(2/123 例)に認められた。
副作用は、250 mg Q4W 群 17.3%(14/81 例)
、250 mg Q2W 群 25.2%(31/123 例)
、プラセボ群 13.4%
(11/82 例)に認められた。
6
投与 16 週時に IGA (0/1)を達成した被験者における
投与 16 週時に EASI-75 を達成した被験者における
IGA (0/1)達成を維持した被験者の割合
EASI-75 達成を維持した被験者の割合
週数
250 mg Q4W/Q4W
250 mg Q2W/Q4W
250 mg Q2W/Q2W
250 mg Q4W/Q4W
250 mg Q2W/Q4W
250 mg Q2W/Q2W
投与例 a)
投与例 b)
投与例 c)
投与例 a)
投与例 b)
投与例 c)
16 週
100 (23/23)
100 (16/16)
100 (24/24)
100 (38/38)
100 (33/33)
100 (29/29)
24 週
73.9 (17/23)
75.0 (12/16)
75.0 (18/24)
86.8 (33/38)
93.9 (31/33)
89.7 (26/29)
32 週
52.2 (12/23)
68.8 (11/16)
75.0 (18/24)
89.5 (34/38)
81.8 (27/33)
86.2 (25/29)
40 週
52.2 (12/23)
62.5 (10/16)
79.2 (19/24)
81.6 (31/38)
84.8 (28/33)
89.7 (26/29)
52 週
69.6 (16/23)
50.0 (8/16)
66.7 (16/24)
81.6 (31/38)
72.7 (24/33)
89.7 (26/29)
68 週
60.9 (14/23)
56.3 (9/16)
70.8 (17/24)
73.7 (28/38)
75.8 (25/33)
79.3 (23/29)
%(例数)
、NRI:Nonresponder imputation
救援治療を受けた又は投与を中止した被験者並びにエスケープ維持期へ移行した被験者、その他データが欠測となった被験者は無効とされ
た
a) 250 mg Q4W 群の後、二重盲検維持期において本剤 250 mg を Q4W で皮下投与した集団
b) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q4W で皮下投与した集団
c) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q2W で皮下投与した集団
(安全性)
導入期における有害事象は、250 mg Q4W 群 60.5%(49/81 例)
、250 mg Q2W 群 75.6%(93/123 例)
、
プラセボ群 63.4%(52/82 例)に認められ、主な事象は表 3 のとおりであった。
死亡は、認められなかった。
重篤な有害事象は、250 mg Q2W 群 0.8%(1/123 例〔脳梗塞〕
)
、プラセボ群 2.4%(2/82 例〔COVID19、カンピロバクター胃腸炎各 1 例〕
)に認められたが、いずれも治験薬との因果関係は否定され
た。
投与中止に至った有害事象は、250 mg Q2W 群 1.6%(2/123 例)に認められた。
副作用は、250 mg Q4W 群 17.3%(14/81 例)
、250 mg Q2W 群 25.2%(31/123 例)
、プラセボ群 13.4%
(11/82 例)に認められた。
6