よむ、つかう、まなぶ。
総-3-1○最適使用推進ガイドラインについて (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00251.html |
| 出典情報 | 中央社会保険医療協議会 総会(第587回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
事象名
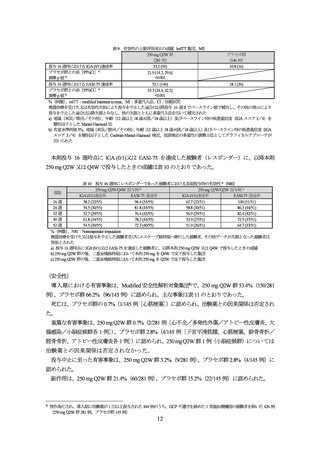
表 3 いずれかの群で 2%以上に認められた有害事象(安全性解析集団〔導入期〕)
250 mg
250 mg
250 mg
プラセボ群
Q4W 群
Q2W 群
Q4W 群
事象名
(82 例)
(81 例)
(123 例)
(81 例)
皮膚感染
15 (18.5)
25 (20.3)
13 (15.9)
1 (1.2)
アトピー性皮膚炎
10 (12.3)
21 (17.1)
4 (4.9)
1 (1.2)
5 (6.2)
12 (9.8)
2 (2.4)
靭帯捻挫
1 (1.2)
5 (6.2)
7 (5.7)
8 (9.8)
肝斑a)
1 (4.0)
5 (6.2)
7 (5.7)
2 (2.4)
子宮内膜症a)
1 (4.0)
倦怠感
3 (3.7)
4 (3.3)
9 (11.0)
0
四肢痛
3 (3.7)
4 (3.3)
4 (4.9)
0
注射部位反応
2 (2.5)
6 (4.9)
2 (2.4)
0
2 (2.5)
4 (3.3)
5 (6.1)
アレルギー性鼻炎
0
2 (2.5)
2 (1.6)
2 (2.4)
接触皮膚炎
0
2 (2.5)
2 (1.6)
0
月経困難症a)
0
注射部位疼痛
2 (2.5)
1 (0.8)
3 (3.7)
0
皮膚擦過傷
2 (2.5)
0
2 (2.4)
0
マラセチア感染
2 (2.5)
0
0
0
2 (2.5)
0
0
脂質異常症
0
2 (2.5)
0
0
蜂巣炎
0
1 (1.2)
5 (4.1)
0
外耳炎
0
ALT 増加
1 (1.2)
3 (2.4)
0
0
AST 増加
1 (1.2)
3 (2.4)
0
0
外陰部膣カンジダ症a)
1 (1.2)
3 (2.4)
0
0
1 (1.2)
2 (1.6)
2 (2.4)
不規則月経a)
0
1 (1.2)
1 (0.8)
2 (2.4)
月経前頭痛a)
0
250 mg
Q2W 群
(123 例)
1 (0.8)
0
0
0
0
4 (3.3)
4 (3.3)
3 (2.4)
3 (2.4)
3 (2.4)
2 (4.9)
1 (0.8)
1 (0.8)
1 (0.8)
1 (0.8)
0
0
0
0
0
0
0
発熱
アレルギー性結膜炎
結膜炎
毛包炎
上咽頭炎
頭痛
ワクチン接種部位疼痛
口腔ヘルペス
ざ瘡
下痢
背部痛
COVID-19
蕁麻疹
湿疹
細菌性結膜炎
高尿酸血症
筋肉痛
眼そう痒症
関節痛
皮膚乳頭腫
ドライアイ
単純ヘルペス
例数(%)
a) 女性特異的な事象のため、女性被験者 250 mg Q4W 群 25 例、250 mg Q2W 群 41 例、プラセボ群 24 例を分母として算出
プラセボ群
(82 例)
2 (2.4)
2 (2.4)
2 (2.4)
0
0
2 (2.4)
0
0
0
0
0
2 (2.4)
2 (2.4)
2 (2.4)
2 (2.4)
3 (3.7)
3 (3.7)
2 (2.4)
2 (2.4)
1 (4.2)
1 (4.2)
1 (4.2)
全投与期間における有害事象は、無作為化され、全投与期間で 1 回以上の本剤投与を受け
た全ての被験者(以下、
「全レブリキズマブ安全性集団」
)の 91.7%(253/276 例)に認めら
れ、主な事象は表 4 のとおりであった。
死亡は、認められなかった。
重篤な有害事象は、2.9%(8/276 例〔COVID-19、脳梗塞、靱帯損傷、虫垂炎、扁桃炎、ア
ナフィラキシー反応、抜歯、ホジキン病各 1 例〕
)に認められ、このうち 2 例(扁桃炎、ア
ナフィラキシー反応各 1 例)については治験薬との因果関係は否定されなかった。
投与中止に至った有害事象は、1.4%(4/276 例)に認められた。
副作用は、35.5%(98/276 例)に認められた。
7
表 3 いずれかの群で 2%以上に認められた有害事象(安全性解析集団〔導入期〕)
250 mg
250 mg
250 mg
プラセボ群
Q4W 群
Q2W 群
Q4W 群
事象名
(82 例)
(81 例)
(123 例)
(81 例)
皮膚感染
15 (18.5)
25 (20.3)
13 (15.9)
1 (1.2)
アトピー性皮膚炎
10 (12.3)
21 (17.1)
4 (4.9)
1 (1.2)
5 (6.2)
12 (9.8)
2 (2.4)
靭帯捻挫
1 (1.2)
5 (6.2)
7 (5.7)
8 (9.8)
肝斑a)
1 (4.0)
5 (6.2)
7 (5.7)
2 (2.4)
子宮内膜症a)
1 (4.0)
倦怠感
3 (3.7)
4 (3.3)
9 (11.0)
0
四肢痛
3 (3.7)
4 (3.3)
4 (4.9)
0
注射部位反応
2 (2.5)
6 (4.9)
2 (2.4)
0
2 (2.5)
4 (3.3)
5 (6.1)
アレルギー性鼻炎
0
2 (2.5)
2 (1.6)
2 (2.4)
接触皮膚炎
0
2 (2.5)
2 (1.6)
0
月経困難症a)
0
注射部位疼痛
2 (2.5)
1 (0.8)
3 (3.7)
0
皮膚擦過傷
2 (2.5)
0
2 (2.4)
0
マラセチア感染
2 (2.5)
0
0
0
2 (2.5)
0
0
脂質異常症
0
2 (2.5)
0
0
蜂巣炎
0
1 (1.2)
5 (4.1)
0
外耳炎
0
ALT 増加
1 (1.2)
3 (2.4)
0
0
AST 増加
1 (1.2)
3 (2.4)
0
0
外陰部膣カンジダ症a)
1 (1.2)
3 (2.4)
0
0
1 (1.2)
2 (1.6)
2 (2.4)
不規則月経a)
0
1 (1.2)
1 (0.8)
2 (2.4)
月経前頭痛a)
0
250 mg
Q2W 群
(123 例)
1 (0.8)
0
0
0
0
4 (3.3)
4 (3.3)
3 (2.4)
3 (2.4)
3 (2.4)
2 (4.9)
1 (0.8)
1 (0.8)
1 (0.8)
1 (0.8)
0
0
0
0
0
0
0
発熱
アレルギー性結膜炎
結膜炎
毛包炎
上咽頭炎
頭痛
ワクチン接種部位疼痛
口腔ヘルペス
ざ瘡
下痢
背部痛
COVID-19
蕁麻疹
湿疹
細菌性結膜炎
高尿酸血症
筋肉痛
眼そう痒症
関節痛
皮膚乳頭腫
ドライアイ
単純ヘルペス
例数(%)
a) 女性特異的な事象のため、女性被験者 250 mg Q4W 群 25 例、250 mg Q2W 群 41 例、プラセボ群 24 例を分母として算出
プラセボ群
(82 例)
2 (2.4)
2 (2.4)
2 (2.4)
0
0
2 (2.4)
0
0
0
0
0
2 (2.4)
2 (2.4)
2 (2.4)
2 (2.4)
3 (3.7)
3 (3.7)
2 (2.4)
2 (2.4)
1 (4.2)
1 (4.2)
1 (4.2)
全投与期間における有害事象は、無作為化され、全投与期間で 1 回以上の本剤投与を受け
た全ての被験者(以下、
「全レブリキズマブ安全性集団」
)の 91.7%(253/276 例)に認めら
れ、主な事象は表 4 のとおりであった。
死亡は、認められなかった。
重篤な有害事象は、2.9%(8/276 例〔COVID-19、脳梗塞、靱帯損傷、虫垂炎、扁桃炎、ア
ナフィラキシー反応、抜歯、ホジキン病各 1 例〕
)に認められ、このうち 2 例(扁桃炎、ア
ナフィラキシー反応各 1 例)については治験薬との因果関係は否定されなかった。
投与中止に至った有害事象は、1.4%(4/276 例)に認められた。
副作用は、35.5%(98/276 例)に認められた。
7