よむ、つかう、まなぶ。
総-3-1○最適使用推進ガイドラインについて (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00251.html |
| 出典情報 | 中央社会保険医療協議会 総会(第587回 4/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
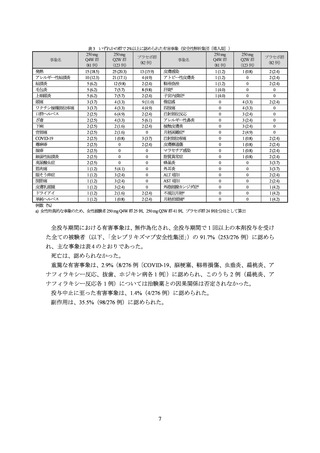
表 9 有効性の主要評価項目の成績(mITT 集団、MI)
250 mg Q2W 群
(281 例)
投与 16 週時における IGA (0/1)達成率
33.2 (93)
プラセボ群との差[95%CI]a)
21.9 [14.2, 29.6]
<0.001
調整 p 値 b)
プラセボ群
(146 例)
10.8 (16)
投与 16 週時における EASI-75 達成率
52.1 (146)
18.1 (26)
プラセボ群との差[95%CI]a)
33.3 [24.4, 42.2]
<0.001
調整 p 値 b)
%(例数)
、mITT:modified Intention to treat、MI:多重代入法、CI:信頼区間
救援治療を受けた又は有効性欠如により投与を中止した場合は以降投与 16 週までベースライン値で補完し、その他の理由により
投与を中止した場合は以降欠測とみなし、他の欠測とともに多重代入法を用いて補完された
a) 地域(米国/欧州/その他)
、年齢(12 歳以上 18 歳未満/18 歳以上)及びベースライン時の疾患重症度(IGA スコア 3/4)を
層別因子とした Mantel-Haenszel 法
b) 有意水準両側 5%、地域(米国/欧州/その他)
、年齢(12 歳以上 18 歳未満/18 歳以上)及びベースライン時の疾患重症度(IGA
スコア 3/4)を層別因子とした Cochran-Mantel-Haenszel 検定。仮説検定の多重性の調整方法としてグラフィカルアプローチが
用いられた
本剤投与 16 週時点に IGA (0/1)又は EASI-75 を達成した被験者(レスポンダー)に、以降本剤
250 mg Q2W 又は Q4W で投与したときの成績は表 10 のとおりであった。
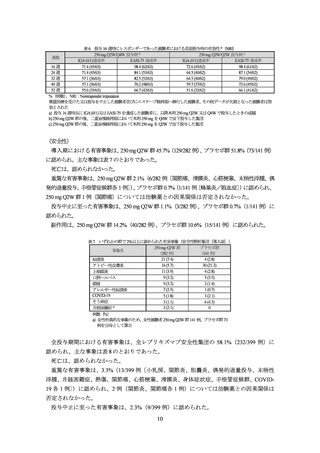
表 10 投与 16 週時にレスポンダーであった被験者における長期投与時の有効性 a)(NRI)
250 mg Q2W/Q4W 投与例 b)
250 mg Q2W/Q2W 投与例 c)
週数
IGA (0/1)達成率
EASI-75 達成率
IGA (0/1)達成率
EASI-75 達成率
16 週
58.2 (32/55)
96.4 (53/55)
62.7 (32/51)
100 (51/51)
24 週
54.5 (30/55)
81.8 (45/55)
58.8 (30/51)
86.3 (44/51)
32 週
52.7 (29/55)
76.4 (42/55)
56.9 (29/51)
82.4 (42/51)
40 週
61.8 (34/55)
78.2 (43/55)
52.9 (27/51)
72.5 (37/51)
52 週
54.5 (30/55)
72.7 (40/55)
51.0 (26/51)
64.7 (33/51)
%(例数)
、NRI:Nonresponder imputation
救援治療を受けた又は投与を中止した被験者並びにエスケープ維持期へ移行した被験者、その他データが欠測となった被験者は
無効とされた
a) 投与 16 週時点に IGA (0/1)又は EASI-75 を達成した被験者に、以降本剤 250 mg Q2W 又は Q4W で投与したときの成績
b) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q4W で皮下投与した集団
c) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q2W で皮下投与した集団
(安全性)
導入期における有害事象は、Modified 安全性解析対象集団8)で、250 mg Q2W 群 53.4%(150/281
例)
、プラセボ群 66.2%(96/145 例)に認められ、主な事象は表 11 のとおりであった。
死亡は、プラセボ群の 0.7%(1/145 例〔心筋梗塞〕
)に認められ、治験薬との因果関係は否定され
た。
重篤な有害事象は、250 mg Q2W 群 0.7%(2/281 例〔心不全/多発性外傷/アトピー性皮膚炎、大
腸感染/小脳症候群各 1 例〕
)
、プラセボ群 2.8%(4/145 例〔子宮平滑筋腫、心筋梗塞、腓骨骨折/
脛骨骨折、アトピー性皮膚炎各 1 例〕
)に認められ、250 mg Q2W 群 1 例(小脳症候群)については
治験薬との因果関係は否定されなかった。
投与中止に至った有害事象は、250 mg Q2W 群 3.2%(9/281 例)
、プラセボ群 2.8%(4/145 例)に
認められた。
副作用は、250 mg Q2W 群 21.4%(60/281 例)
、プラセボ群 15.2%(22/145 例)に認められた。
8)
無作為化され、導入期に治験薬が 1 回以上投与された 444 例のうち、GCP 不遵守を認めた 1 実施医療機関の被験者を除いた 426 例
(250 mg Q2W 群 281 例、プラセボ群 145 例)
12
250 mg Q2W 群
(281 例)
投与 16 週時における IGA (0/1)達成率
33.2 (93)
プラセボ群との差[95%CI]a)
21.9 [14.2, 29.6]
<0.001
調整 p 値 b)
プラセボ群
(146 例)
10.8 (16)
投与 16 週時における EASI-75 達成率
52.1 (146)
18.1 (26)
プラセボ群との差[95%CI]a)
33.3 [24.4, 42.2]
<0.001
調整 p 値 b)
%(例数)
、mITT:modified Intention to treat、MI:多重代入法、CI:信頼区間
救援治療を受けた又は有効性欠如により投与を中止した場合は以降投与 16 週までベースライン値で補完し、その他の理由により
投与を中止した場合は以降欠測とみなし、他の欠測とともに多重代入法を用いて補完された
a) 地域(米国/欧州/その他)
、年齢(12 歳以上 18 歳未満/18 歳以上)及びベースライン時の疾患重症度(IGA スコア 3/4)を
層別因子とした Mantel-Haenszel 法
b) 有意水準両側 5%、地域(米国/欧州/その他)
、年齢(12 歳以上 18 歳未満/18 歳以上)及びベースライン時の疾患重症度(IGA
スコア 3/4)を層別因子とした Cochran-Mantel-Haenszel 検定。仮説検定の多重性の調整方法としてグラフィカルアプローチが
用いられた
本剤投与 16 週時点に IGA (0/1)又は EASI-75 を達成した被験者(レスポンダー)に、以降本剤
250 mg Q2W 又は Q4W で投与したときの成績は表 10 のとおりであった。
表 10 投与 16 週時にレスポンダーであった被験者における長期投与時の有効性 a)(NRI)
250 mg Q2W/Q4W 投与例 b)
250 mg Q2W/Q2W 投与例 c)
週数
IGA (0/1)達成率
EASI-75 達成率
IGA (0/1)達成率
EASI-75 達成率
16 週
58.2 (32/55)
96.4 (53/55)
62.7 (32/51)
100 (51/51)
24 週
54.5 (30/55)
81.8 (45/55)
58.8 (30/51)
86.3 (44/51)
32 週
52.7 (29/55)
76.4 (42/55)
56.9 (29/51)
82.4 (42/51)
40 週
61.8 (34/55)
78.2 (43/55)
52.9 (27/51)
72.5 (37/51)
52 週
54.5 (30/55)
72.7 (40/55)
51.0 (26/51)
64.7 (33/51)
%(例数)
、NRI:Nonresponder imputation
救援治療を受けた又は投与を中止した被験者並びにエスケープ維持期へ移行した被験者、その他データが欠測となった被験者は
無効とされた
a) 投与 16 週時点に IGA (0/1)又は EASI-75 を達成した被験者に、以降本剤 250 mg Q2W 又は Q4W で投与したときの成績
b) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q4W で皮下投与した集団
c) 250 mg Q2W 群の後、二重盲検維持期において本剤 250 mg を Q2W で皮下投与した集団
(安全性)
導入期における有害事象は、Modified 安全性解析対象集団8)で、250 mg Q2W 群 53.4%(150/281
例)
、プラセボ群 66.2%(96/145 例)に認められ、主な事象は表 11 のとおりであった。
死亡は、プラセボ群の 0.7%(1/145 例〔心筋梗塞〕
)に認められ、治験薬との因果関係は否定され
た。
重篤な有害事象は、250 mg Q2W 群 0.7%(2/281 例〔心不全/多発性外傷/アトピー性皮膚炎、大
腸感染/小脳症候群各 1 例〕
)
、プラセボ群 2.8%(4/145 例〔子宮平滑筋腫、心筋梗塞、腓骨骨折/
脛骨骨折、アトピー性皮膚炎各 1 例〕
)に認められ、250 mg Q2W 群 1 例(小脳症候群)については
治験薬との因果関係は否定されなかった。
投与中止に至った有害事象は、250 mg Q2W 群 3.2%(9/281 例)
、プラセボ群 2.8%(4/145 例)に
認められた。
副作用は、250 mg Q2W 群 21.4%(60/281 例)
、プラセボ群 15.2%(22/145 例)に認められた。
8)
無作為化され、導入期に治験薬が 1 回以上投与された 444 例のうち、GCP 不遵守を認めた 1 実施医療機関の被験者を除いた 426 例
(250 mg Q2W 群 281 例、プラセボ群 145 例)
12