よむ、つかう、まなぶ。
総-2-1○最適使用推進ガイドラインについて(報告) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00254.html |
| 出典情報 | 中央社会保険医療協議会 総会(第589回 5/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
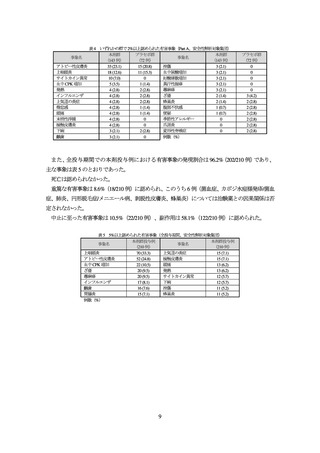
表 8 QOL に関する主な有効性評価項目の成績(FAS)
評価時期
本剤群
プラセボ群
プラセボ→本剤群
ベースライン
8.1±4.3 (45)
8.5±4.2 (44)
4週
3.0±3.2 (45)
6.2±3.5 (44)
8週
3.1±2.8 (45)
5.6±3.3 (44)
16 週
2.4±2.5 (45)
5.3±3.4 (44)
CDLQI(OC)
32 週
2.3±2.2 (44)
3.0±2.9 (43)
44 週
1.9±1.9 (44)
2.4±2.9 (42)
68 週
1.7±1.9 (43)
1.8±1.3 (39)
4週
73.8 (31/42)
50.0 (21/42)
8週
78.6 (33/42)
54.8 (23/42)
CDLQI≧2.5 改善達成率
16 週
83.3 (35/42)
57.1 (24/42)
(ベースラインの CDLQI が 2.5
32
週
76.2
(32/42)
78.6 (33/42)
以上の被験者対象)(NRI)a)
44 週
81.0 (34/42)
81.0 (34/42)
68 週
85.7 (36/42)
83.3 (35/42)
ベースライン
8.2±5.9 (45)
8.7±5.4 (44)
4週
4.3±3.4 (45)
6.5±4.8 (44)
16 週
3.8±3.4 (45)
6.0±4.4 (44)
DFI(OC)
32 週
3.1±2.7 (44)
3.5±3.7 (43)
44 週
2.8±2.7 (44)
3.3±3.7 (42)
68 週
2.0±2.0 (43)
2.4±2.7 (39)
平均値±標準偏差(例数)又は%(例数)、網掛け部:主要評価時点の成績
a) 各評価時点において各評価項目の評価対象となった被験者に対する達成した被験者の割合。各評価時点が欠測している被験
者はノンレスポンダーとされた
評価項目
(安全性)
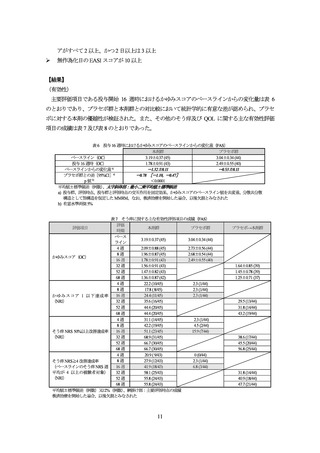
Part A における有害事象は、本剤群 73.9%(34/46 例)、プラセボ群 65.1%(28/43 例)に認めら
れ、主な事象は表 9 のとおりであった。
死亡及び中止に至った有害事象は、認められなかった。
重篤な有害事象は、本剤群 4.3%(2/46 例)に認められたが、いずれも治験薬との因果関係は否定
された。
副作用は、本剤群 19.6%(9/46 例)、プラセボ群 4.7%(2/43 例)に認められた。
事象名
アトピー性皮膚炎
上気道の炎症
膿痂疹
上咽頭炎
頭痛
紅斑
蕁麻疹
下痢
胃腸炎
表 9 いずれかの群で 2 例以上に認められた有害事象(Part A、安全性解析対象集団)
本剤群
プラセボ群
本剤群
事象名
(46 例)
(43 例)
(46 例)
汗疹
5 (10.9)
5 (11.6)
2 (4.3)
肝機能異常
4 (8.7)
2 (4.7)
2 (4.3)
3 (6.5)
3 (7.0)
ワクチン接種合併症
2 (4.3)
ざ瘡
3 (6.5)
3 (7.0)
1 (2.2)
3 (6.5)
2 (4.7)
齲歯
1 (2.2)
3 (6.5)
1 (2.3)
毛包炎
1 (2.2)
爪囲炎
2 (4.3)
1 (2.3)
1 (2.2)
2 (4.3)
1 (2.3)
発熱
0
2 (4.3)
0
例数(%)
プラセボ群
(43 例)
0
0
0
3 (7.0)
3 (7.0)
2 (4.7)
2 (4.7)
3 (7.0)
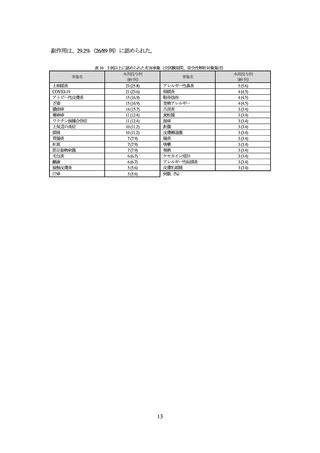
全投与期間における有害事象は 93.3%(83/89 例)に認められ、主な事象は表 10 のとおりであ
った。
死亡は、認められなかった。
重篤な有害事象は 3.4%(3/89 例)に認められ、このうち 1 例(膿痂疹)については、治験薬との
因果関係が否定されなかった。
中止に至った有害事象は、1.1%(1/89 例)に認められた。
12
評価時期
本剤群
プラセボ群
プラセボ→本剤群
ベースライン
8.1±4.3 (45)
8.5±4.2 (44)
4週
3.0±3.2 (45)
6.2±3.5 (44)
8週
3.1±2.8 (45)
5.6±3.3 (44)
16 週
2.4±2.5 (45)
5.3±3.4 (44)
CDLQI(OC)
32 週
2.3±2.2 (44)
3.0±2.9 (43)
44 週
1.9±1.9 (44)
2.4±2.9 (42)
68 週
1.7±1.9 (43)
1.8±1.3 (39)
4週
73.8 (31/42)
50.0 (21/42)
8週
78.6 (33/42)
54.8 (23/42)
CDLQI≧2.5 改善達成率
16 週
83.3 (35/42)
57.1 (24/42)
(ベースラインの CDLQI が 2.5
32
週
76.2
(32/42)
78.6 (33/42)
以上の被験者対象)(NRI)a)
44 週
81.0 (34/42)
81.0 (34/42)
68 週
85.7 (36/42)
83.3 (35/42)
ベースライン
8.2±5.9 (45)
8.7±5.4 (44)
4週
4.3±3.4 (45)
6.5±4.8 (44)
16 週
3.8±3.4 (45)
6.0±4.4 (44)
DFI(OC)
32 週
3.1±2.7 (44)
3.5±3.7 (43)
44 週
2.8±2.7 (44)
3.3±3.7 (42)
68 週
2.0±2.0 (43)
2.4±2.7 (39)
平均値±標準偏差(例数)又は%(例数)、網掛け部:主要評価時点の成績
a) 各評価時点において各評価項目の評価対象となった被験者に対する達成した被験者の割合。各評価時点が欠測している被験
者はノンレスポンダーとされた
評価項目
(安全性)
Part A における有害事象は、本剤群 73.9%(34/46 例)、プラセボ群 65.1%(28/43 例)に認めら
れ、主な事象は表 9 のとおりであった。
死亡及び中止に至った有害事象は、認められなかった。
重篤な有害事象は、本剤群 4.3%(2/46 例)に認められたが、いずれも治験薬との因果関係は否定
された。
副作用は、本剤群 19.6%(9/46 例)、プラセボ群 4.7%(2/43 例)に認められた。
事象名
アトピー性皮膚炎
上気道の炎症
膿痂疹
上咽頭炎
頭痛
紅斑
蕁麻疹
下痢
胃腸炎
表 9 いずれかの群で 2 例以上に認められた有害事象(Part A、安全性解析対象集団)
本剤群
プラセボ群
本剤群
事象名
(46 例)
(43 例)
(46 例)
汗疹
5 (10.9)
5 (11.6)
2 (4.3)
肝機能異常
4 (8.7)
2 (4.7)
2 (4.3)
3 (6.5)
3 (7.0)
ワクチン接種合併症
2 (4.3)
ざ瘡
3 (6.5)
3 (7.0)
1 (2.2)
3 (6.5)
2 (4.7)
齲歯
1 (2.2)
3 (6.5)
1 (2.3)
毛包炎
1 (2.2)
爪囲炎
2 (4.3)
1 (2.3)
1 (2.2)
2 (4.3)
1 (2.3)
発熱
0
2 (4.3)
0
例数(%)
プラセボ群
(43 例)
0
0
0
3 (7.0)
3 (7.0)
2 (4.7)
2 (4.7)
3 (7.0)
全投与期間における有害事象は 93.3%(83/89 例)に認められ、主な事象は表 10 のとおりであ
った。
死亡は、認められなかった。
重篤な有害事象は 3.4%(3/89 例)に認められ、このうち 1 例(膿痂疹)については、治験薬との
因果関係が否定されなかった。
中止に至った有害事象は、1.1%(1/89 例)に認められた。
12