よむ、つかう、まなぶ。
総-2-1○最適使用推進ガイドラインについて(報告) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00254.html |
| 出典情報 | 中央社会保険医療協議会 総会(第589回 5/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
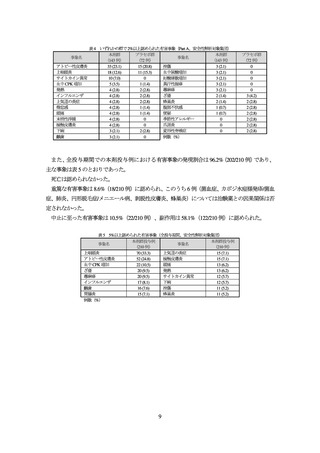
表 3 QOL に関する主な有効性評価項目の成績(全期間 FAS)
評価時期
本剤群
プラセボ群
ベースライン
12.4±5.4 (132)
12.2±5.5 (65)
4週
7.4±5.5 (134)
9.8±6.0 (65)
8週
7.4±5.2 (134)
9.7±5.6 (65)
DLQI(OC)
16 週
6.6±4.9 (134)
8.9±5.8 (65)
(16 歳以上)
32 週
4.7±3.8 (128)
-
44 週
4.6±4.0 (129)
-
68 週
3.9±3.6 (128)
-
4週
33.6 (42/125)
17.5 (11/63)
8週
32.8 (41/125)
17.5 (11/63)
4 以下を達成した
16 週
40.0 (50/125)
23.8 (15/63)
被験者の割合(NRI)
(ベースラインの DLQI が
32 週
53.6 (67/125)
-
5 以上の被験者対象)
44 週
-
54.4 (68/125)
68 週
-
64.8 (81/125)
4週
64.3 (83/129)
40.6 (26/64)
8週
62.8 (81/129)
42.2 (27/64)
4 ポイント以上改善した
16 週
68.2 (88/129)
53.1 (34/64)
被験者の割合(NRI)
(ベースラインの DLQI が
32 週
75.2 (97/129)
-
4 以上の被験者対象)
44 週
-
72.1 (93/129)
68 週
79.8 (103/129)
-
ベースライン
11.2±6.6 (5)
3, 6 (2)
4週
5.2±3.0 (5)
6, 7 (2)
8週
4.6±3.0 (5)
6, 12 (2)
CDLQI(OC)
16 週
4.2±4.2 (5)
9, 10 (2)
(16 歳未満)
32 週
2.5±2.1 (4)
-
44 週
1.5±1.9 (4)
-
68 週
1.0±1.4 (4)
-
4週
41.0 (43/105)
17.3 (9/52)
8週
44.8 (47/105)
13.5 (7/52)
ISI が 7 以下を達成した
16 週
56.2 (59/105)
21.2 (11/52)
被験者の割合(NRI)
(ベースラインの ISI が
32 週
-
57.1 (60/105)
8 以上の被験者対象)
44 週
56.2 (59/105)
-
68 週
-
61.0 (64/105)
平均値±標準偏差(例数)〔2 例の場合は観測値を記載〕又は%(例数)、-:該当なし
プラセボ→本剤群
-
-
-
-
5.7±4.9 (64)
4.7±3.9 (62)
4.4±3.8 (62)
-
-
-
49.2 (31/63)
54.0 (34/63)
55.6 (35/63)
-
-
-
71.9 (46/64)
82.8 (53/64)
76.6 (49/64)
-
-
-
-
4, 4 (2)
5, 5 (2)
2, 6 (2)
-
-
-
42.3 (22/52)
53.8 (28/52)
55.8 (29/52)
(安全性)
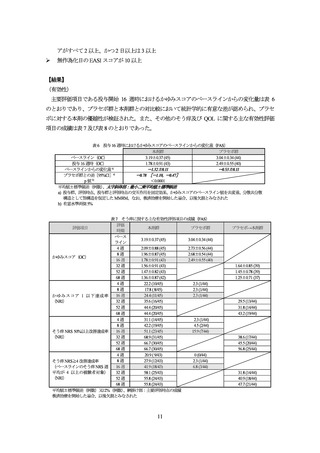
Part A における有害事象は、本剤群 70.6%(101/143 例)、プラセボ群 70.8%(51/72 例)に認めら
れ、主な事象は表 4 のとおりであった。
死亡は認められなかった。
重篤な有害事象は、本剤群 2.1%(3/143 例)、プラセボ群 2.8%(2/72 例)に認められ、このうち
本剤群 2 例(菌血症、円形脱毛症/メニエール病)については治験薬との因果関係は否定されなかっ
た。
中止に至った有害事象は、本剤群 2.1%(3/143 例)に認められた。
副作用は、本剤群 37.1%(53/143 例)、プラセボ群 22.2%(16/72 例)に認められた。
8
評価時期
本剤群
プラセボ群
ベースライン
12.4±5.4 (132)
12.2±5.5 (65)
4週
7.4±5.5 (134)
9.8±6.0 (65)
8週
7.4±5.2 (134)
9.7±5.6 (65)
DLQI(OC)
16 週
6.6±4.9 (134)
8.9±5.8 (65)
(16 歳以上)
32 週
4.7±3.8 (128)
-
44 週
4.6±4.0 (129)
-
68 週
3.9±3.6 (128)
-
4週
33.6 (42/125)
17.5 (11/63)
8週
32.8 (41/125)
17.5 (11/63)
4 以下を達成した
16 週
40.0 (50/125)
23.8 (15/63)
被験者の割合(NRI)
(ベースラインの DLQI が
32 週
53.6 (67/125)
-
5 以上の被験者対象)
44 週
-
54.4 (68/125)
68 週
-
64.8 (81/125)
4週
64.3 (83/129)
40.6 (26/64)
8週
62.8 (81/129)
42.2 (27/64)
4 ポイント以上改善した
16 週
68.2 (88/129)
53.1 (34/64)
被験者の割合(NRI)
(ベースラインの DLQI が
32 週
75.2 (97/129)
-
4 以上の被験者対象)
44 週
-
72.1 (93/129)
68 週
79.8 (103/129)
-
ベースライン
11.2±6.6 (5)
3, 6 (2)
4週
5.2±3.0 (5)
6, 7 (2)
8週
4.6±3.0 (5)
6, 12 (2)
CDLQI(OC)
16 週
4.2±4.2 (5)
9, 10 (2)
(16 歳未満)
32 週
2.5±2.1 (4)
-
44 週
1.5±1.9 (4)
-
68 週
1.0±1.4 (4)
-
4週
41.0 (43/105)
17.3 (9/52)
8週
44.8 (47/105)
13.5 (7/52)
ISI が 7 以下を達成した
16 週
56.2 (59/105)
21.2 (11/52)
被験者の割合(NRI)
(ベースラインの ISI が
32 週
-
57.1 (60/105)
8 以上の被験者対象)
44 週
56.2 (59/105)
-
68 週
-
61.0 (64/105)
平均値±標準偏差(例数)〔2 例の場合は観測値を記載〕又は%(例数)、-:該当なし
プラセボ→本剤群
-
-
-
-
5.7±4.9 (64)
4.7±3.9 (62)
4.4±3.8 (62)
-
-
-
49.2 (31/63)
54.0 (34/63)
55.6 (35/63)
-
-
-
71.9 (46/64)
82.8 (53/64)
76.6 (49/64)
-
-
-
-
4, 4 (2)
5, 5 (2)
2, 6 (2)
-
-
-
42.3 (22/52)
53.8 (28/52)
55.8 (29/52)
(安全性)
Part A における有害事象は、本剤群 70.6%(101/143 例)、プラセボ群 70.8%(51/72 例)に認めら
れ、主な事象は表 4 のとおりであった。
死亡は認められなかった。
重篤な有害事象は、本剤群 2.1%(3/143 例)、プラセボ群 2.8%(2/72 例)に認められ、このうち
本剤群 2 例(菌血症、円形脱毛症/メニエール病)については治験薬との因果関係は否定されなかっ
た。
中止に至った有害事象は、本剤群 2.1%(3/143 例)に認められた。
副作用は、本剤群 37.1%(53/143 例)、プラセボ群 22.2%(16/72 例)に認められた。
8