よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第 29 回 臨床研究部会
令和 3 年度 厚生労働科学特別研究事業(堀田班)
令和 4 年3月 24 日
参考資料
1-2
欧米での観察研究(非介入研究)の規制上の取り扱いに関する調査結果
2022/1/20
0.
サマリ
2018 年 4 月 1 日に施行となった臨床研究法の対象には医薬品等の非介入研究が一部含まれており、その是非が厚生科学
審議会 臨床研究部会での論点となっている。そのため、米国、EU、英国、ICH ガイドラインにおける非介入研究の取り扱いに
ついて、令和 3 年度厚生科学特別研究事業(堀田班)にて調査を行った。
まず、欧米においては医薬品と医療機器の規制要件が明確に分けられているため、両者を区別して調査を行った。各国の
非介入研究の取り扱いのサマリを以下に示す。
参照国/規制
サマリ
米国
連邦助成を受ける人を対象とするすべての研究は、介入の有無によらず被験者保護の基本規則であ
るコモン・ルール(45 CFR 46)の適用を受ける。
医薬品を用いた臨床試験を規制する 21 CFR 312 における IND 申請では、日常診療どおりに医薬品が
用いられる非介入研究は対象外である。
医療機器を用いた臨床試験を行う際に FDA に対して必要な IDE 申請は市販前の医療機器を対象とし
ており、市販の医療機器が用いられる非介入研究は対象外である。
EU
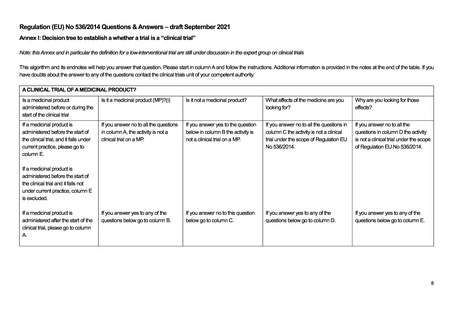
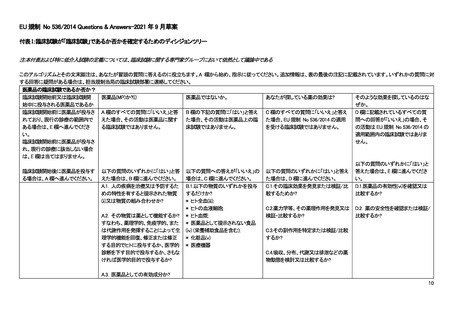
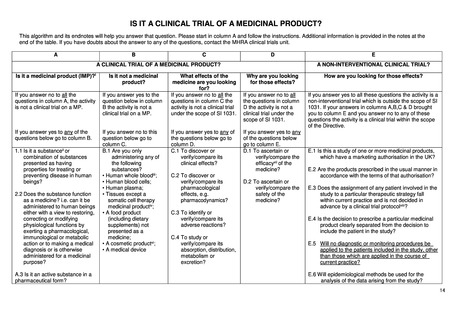
医薬品に関する EU 規制(2014/536; EU-CTR)は、非介入研究には適用されない。ただし、EU-CTR で
の介入の定義には、医薬品だけではなく日常診療を超える診断やモニタリングの上乗せも含まれ、そ
の目的が有効性・安全性等を明らかにすることであれば EU-CTR の対象となり得る。ただし、こうした
診断やモニタリングの介入の多くは低介入臨床試験(low-interventional clinical trial)に分類され、その
場合には、モニタリングや医薬品管理、必須文書の内容、補償等の義務が大幅に緩和される。
医療機器に関する EU 規制(2017/745; EU-MDR)は、医療機器及びその付属品の上市や使用開始に関
する規則であり、医療機器の安全性または性能を評価するために行われるヒトを対象とした研究に広く
適用される。植込み機器およびクラス III 機器では、原則、臨床研究(clinical investigation)を実施しなけ
ればならず、全般的にクラス分類や植込み機器かどうかによる規定の場合分けがなされており、介入
の有無によって規制の該当性は区別されていない。
英国
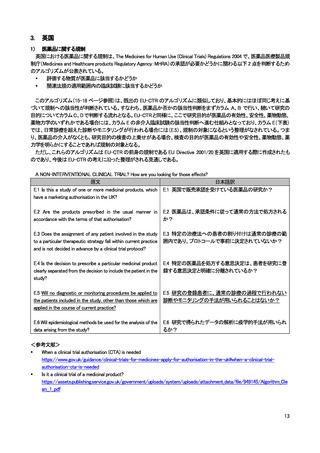
英国における医薬品に関する規制である The Medicines for Human Use (Clinical Trials) Regulations
2004 では非介入研究(non-interventional clinical trial)は上記の規制の対象外とされている。ただし、介
入の定義は EU-CTR と同様の考え方であり、日常診療を超える診断やモニタリングの上乗せが行わ
れ、その目的が有効性・安全性等を明らかにすることであれば規制の対象となり得る。
現在の英国の医薬品規制は EU Directive (2001/20)をベースにしたものであり、新たな EU regulation
(536/2014)の施行にあわせて、規制要件の調和が図られる見通しである。
英国における医療機器の規制は、今後 EU-MDR 等の国際的な規制要件への調和が図られる見通しで
ある。
ICH-E6/E8
ICH-E6(ICH-GCP)、ICH-E8(臨床試験の一般原則)の対象は医薬品を用いる介入研究(interventional
studies for medical products)であり、非介入研究は対象外である。
臨床研究部会で争点となっているのは、医薬品の介入を伴わないものの、研究目的で相応の負担を伴う検査を行う研究を
法の対象とすべきか否かという点である。こうした研究は、米国での IND 申請や ICH-E6/E8 では適用対象外である。一方、
EU regulation(536/2014)や英国の医薬品規制では、研究目的が有効性・安全性・薬物動態・薬力学を明らかにすることであれ
ば規制の対象となり得るが、EU regulation(536/2014)ではこのような研究でも「低介入臨床試験」に分類される場合があり、そ
の際には簡略化した手順で研究が実施可能となっている。
医療機器については、米国、EU、英国ともに医薬品とは全く別の規制要件が設けられている。医療機器の非介入研究は米
国 FDA への各種申請の対象外である。EU では医療機器の介入の有無によって規制の該当性は区別されておらず、クラス
分類や植込み機器に該当するか否かで規定の場合分けがなされている。
1
令和 3 年度 厚生労働科学特別研究事業(堀田班)
令和 4 年3月 24 日
参考資料
1-2
欧米での観察研究(非介入研究)の規制上の取り扱いに関する調査結果
2022/1/20
0.
サマリ
2018 年 4 月 1 日に施行となった臨床研究法の対象には医薬品等の非介入研究が一部含まれており、その是非が厚生科学
審議会 臨床研究部会での論点となっている。そのため、米国、EU、英国、ICH ガイドラインにおける非介入研究の取り扱いに
ついて、令和 3 年度厚生科学特別研究事業(堀田班)にて調査を行った。
まず、欧米においては医薬品と医療機器の規制要件が明確に分けられているため、両者を区別して調査を行った。各国の
非介入研究の取り扱いのサマリを以下に示す。
参照国/規制
サマリ
米国
連邦助成を受ける人を対象とするすべての研究は、介入の有無によらず被験者保護の基本規則であ
るコモン・ルール(45 CFR 46)の適用を受ける。
医薬品を用いた臨床試験を規制する 21 CFR 312 における IND 申請では、日常診療どおりに医薬品が
用いられる非介入研究は対象外である。
医療機器を用いた臨床試験を行う際に FDA に対して必要な IDE 申請は市販前の医療機器を対象とし
ており、市販の医療機器が用いられる非介入研究は対象外である。
EU
医薬品に関する EU 規制(2014/536; EU-CTR)は、非介入研究には適用されない。ただし、EU-CTR で
の介入の定義には、医薬品だけではなく日常診療を超える診断やモニタリングの上乗せも含まれ、そ
の目的が有効性・安全性等を明らかにすることであれば EU-CTR の対象となり得る。ただし、こうした
診断やモニタリングの介入の多くは低介入臨床試験(low-interventional clinical trial)に分類され、その
場合には、モニタリングや医薬品管理、必須文書の内容、補償等の義務が大幅に緩和される。
医療機器に関する EU 規制(2017/745; EU-MDR)は、医療機器及びその付属品の上市や使用開始に関
する規則であり、医療機器の安全性または性能を評価するために行われるヒトを対象とした研究に広く
適用される。植込み機器およびクラス III 機器では、原則、臨床研究(clinical investigation)を実施しなけ
ればならず、全般的にクラス分類や植込み機器かどうかによる規定の場合分けがなされており、介入
の有無によって規制の該当性は区別されていない。
英国
英国における医薬品に関する規制である The Medicines for Human Use (Clinical Trials) Regulations
2004 では非介入研究(non-interventional clinical trial)は上記の規制の対象外とされている。ただし、介
入の定義は EU-CTR と同様の考え方であり、日常診療を超える診断やモニタリングの上乗せが行わ
れ、その目的が有効性・安全性等を明らかにすることであれば規制の対象となり得る。
現在の英国の医薬品規制は EU Directive (2001/20)をベースにしたものであり、新たな EU regulation
(536/2014)の施行にあわせて、規制要件の調和が図られる見通しである。
英国における医療機器の規制は、今後 EU-MDR 等の国際的な規制要件への調和が図られる見通しで
ある。
ICH-E6/E8
ICH-E6(ICH-GCP)、ICH-E8(臨床試験の一般原則)の対象は医薬品を用いる介入研究(interventional
studies for medical products)であり、非介入研究は対象外である。
臨床研究部会で争点となっているのは、医薬品の介入を伴わないものの、研究目的で相応の負担を伴う検査を行う研究を
法の対象とすべきか否かという点である。こうした研究は、米国での IND 申請や ICH-E6/E8 では適用対象外である。一方、
EU regulation(536/2014)や英国の医薬品規制では、研究目的が有効性・安全性・薬物動態・薬力学を明らかにすることであれ
ば規制の対象となり得るが、EU regulation(536/2014)ではこのような研究でも「低介入臨床試験」に分類される場合があり、そ
の際には簡略化した手順で研究が実施可能となっている。
医療機器については、米国、EU、英国ともに医薬品とは全く別の規制要件が設けられている。医療機器の非介入研究は米
国 FDA への各種申請の対象外である。EU では医療機器の介入の有無によって規制の該当性は区別されておらず、クラス
分類や植込み機器に該当するか否かで規定の場合分けがなされている。
1