よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2.
EU
1) 医薬品に関する規制
2014 年 4 月 16 日に制定され、2022 年 1 月 31 日より施行となる、EU 医薬品規制 (EU regulation (2014/536) on medicinal
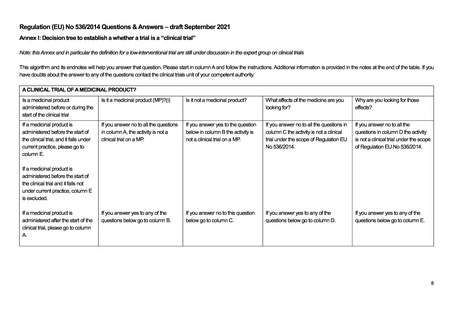
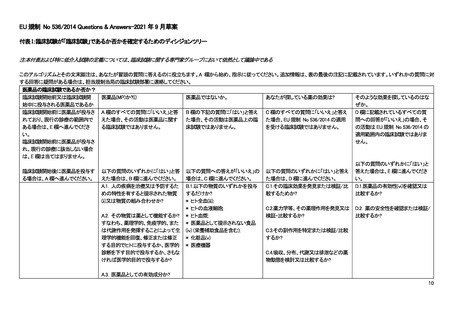
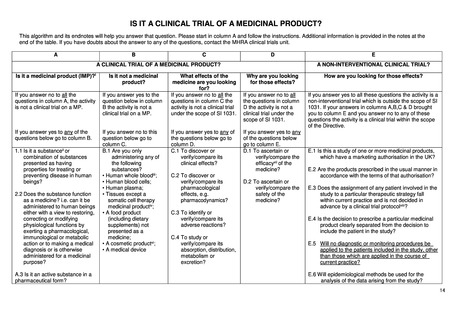
products; EU-CTR)では、「臨床試験」と、臨床試験を含むより広範な概念である「臨床研究」が区別されており、その上で EUCTR 第 1 条の適用範囲で「臨床試験」が対象であることと、非介入研究が適用外であることが明記されている。
ただし、EU-CTR での介入研究の定義には医薬品だけではなく日常を超える診断やモニタリングの介入も含まれ、その介
入の目的が有効性や安全性を明らかにすることであれば EU-CTR の対象となり得る。例えば、医薬品の介入がなくとも、研究
目的の検査の上乗せがある場合、検査の目的が医薬品の有効性や安全性、薬物動態、薬力学を明らかにすることであれば
EU-CTR の対象となり得る。一方、医薬品の介入がなく、医薬品の有効性・安全性を明らかにする目的での検査の上乗せは
あるものの、まったく検査の侵襲がない場合については明確なガイダンスが出ておらず、最終的には規制当局への確認が必
要となる(複数の EU の薬事専門家へのインタビューによる)。
なお、EU-CTR では、「臨床試験」の部分集合として、「低介入臨床試験(low-interventional clinical trial)」が新たに定義されて
おり、これに分類されれば、モニタリングや医薬品管理、必須文書の内容、補償等の義務が大幅に緩和される仕組みとなって
いる。つまり、上記の医薬品の介入がなくとも、研究目的の検査の上乗せがある場合でも、低介入臨床試験にカテゴライズさ
れる場合があり、その際には大幅に簡略化した手順で研究実施が可能となっている。
また、低介入臨床試験にも該当せず、EU-CTR の対象とならない場合には、EU として共通の規制は設けられておらず、各
国の規制要件に従うこととなる。
EU regulations on clinical trials on medicinal products for human use 2014/536
原文
日本語訳
Article 1 Scope
第 1 条 適用範囲
This Regulation applies to all clinical trials conducted in the 本規則は、EU 域内で実施されるすべての臨床試験に適用
Union.
される。
It does not apply to non-interventional studies.
非介入研究には適用されない。
Article 2 Definitions
第 2 条 定義
(1) ‘ Clinical study’ means any investigation in relation to (1) 「臨床研究」とは、医薬品の安全性および/または有効
humans intended:
性を確認することを目的として、以下を意図したヒトを対象と
(a) to discover or verify the clinical, pharmacological or するあらゆる研究をいう
other pharmacodynamic effects of one or more
(a) 1 つ以上の医薬品の臨床的、薬理学的またはその
medicinal products;
他の薬力学的効果を発見または検証すること
(b) to identify any adverse reactions to one or more
(b) 1 つ以上の医薬品に対する有害反応を特定するこ
medicinal products; or
と
(c) to study the absorption, distribution, metabolism and
(c) 1 つ以上の医薬品の吸収、分布、代謝および排泄
excretion of one or more medicinal products;
を研究すること
with the objective of ascertaining the safety and/or efficacy of
those medicinal products;
(2)‘Clinical trial’ means a clinical study which fulfils any of the (2) 「臨床試験」とは、以下のいずれかの条件を満たす臨床
following conditions:
研究をいう
(a) the assignment of the subject to a particular
(a) 特定の治療法への被験者の割り付けが、あらかじ
therapeutic strategy is decided in advance and does
め決められており、当該加盟国の通常の診療の
not fall within normal clinical practice of the Member
範囲内ではない
State concerned;
(b) the decision to prescribe the investigational medicinal
(b) 試験薬処方の意思決定は、被験者を臨床研究に
products is taken together with the decision to
登録する意思決定に伴って行われる
include the subject in the clinical study; or
(c) diagnostic or monitoring procedures in addition to
(c) 被験者に対して通常の診療では行われない診断
normal clinical practice are applied to the subjects.
またはモニタリングの手法が用いられる
(3)‘Low-intervention clinical trial’ means a clinical trial which
fulfils all of the following conditions:
(3) 「低介入臨床試験」とは、以下の条件をすべて満たす臨
床試験をいう
6
EU
1) 医薬品に関する規制
2014 年 4 月 16 日に制定され、2022 年 1 月 31 日より施行となる、EU 医薬品規制 (EU regulation (2014/536) on medicinal
products; EU-CTR)では、「臨床試験」と、臨床試験を含むより広範な概念である「臨床研究」が区別されており、その上で EUCTR 第 1 条の適用範囲で「臨床試験」が対象であることと、非介入研究が適用外であることが明記されている。
ただし、EU-CTR での介入研究の定義には医薬品だけではなく日常を超える診断やモニタリングの介入も含まれ、その介
入の目的が有効性や安全性を明らかにすることであれば EU-CTR の対象となり得る。例えば、医薬品の介入がなくとも、研究
目的の検査の上乗せがある場合、検査の目的が医薬品の有効性や安全性、薬物動態、薬力学を明らかにすることであれば
EU-CTR の対象となり得る。一方、医薬品の介入がなく、医薬品の有効性・安全性を明らかにする目的での検査の上乗せは
あるものの、まったく検査の侵襲がない場合については明確なガイダンスが出ておらず、最終的には規制当局への確認が必
要となる(複数の EU の薬事専門家へのインタビューによる)。
なお、EU-CTR では、「臨床試験」の部分集合として、「低介入臨床試験(low-interventional clinical trial)」が新たに定義されて
おり、これに分類されれば、モニタリングや医薬品管理、必須文書の内容、補償等の義務が大幅に緩和される仕組みとなって
いる。つまり、上記の医薬品の介入がなくとも、研究目的の検査の上乗せがある場合でも、低介入臨床試験にカテゴライズさ
れる場合があり、その際には大幅に簡略化した手順で研究実施が可能となっている。
また、低介入臨床試験にも該当せず、EU-CTR の対象とならない場合には、EU として共通の規制は設けられておらず、各
国の規制要件に従うこととなる。
EU regulations on clinical trials on medicinal products for human use 2014/536
原文
日本語訳
Article 1 Scope
第 1 条 適用範囲
This Regulation applies to all clinical trials conducted in the 本規則は、EU 域内で実施されるすべての臨床試験に適用
Union.
される。
It does not apply to non-interventional studies.
非介入研究には適用されない。
Article 2 Definitions
第 2 条 定義
(1) ‘ Clinical study’ means any investigation in relation to (1) 「臨床研究」とは、医薬品の安全性および/または有効
humans intended:
性を確認することを目的として、以下を意図したヒトを対象と
(a) to discover or verify the clinical, pharmacological or するあらゆる研究をいう
other pharmacodynamic effects of one or more
(a) 1 つ以上の医薬品の臨床的、薬理学的またはその
medicinal products;
他の薬力学的効果を発見または検証すること
(b) to identify any adverse reactions to one or more
(b) 1 つ以上の医薬品に対する有害反応を特定するこ
medicinal products; or
と
(c) to study the absorption, distribution, metabolism and
(c) 1 つ以上の医薬品の吸収、分布、代謝および排泄
excretion of one or more medicinal products;
を研究すること
with the objective of ascertaining the safety and/or efficacy of
those medicinal products;
(2)‘Clinical trial’ means a clinical study which fulfils any of the (2) 「臨床試験」とは、以下のいずれかの条件を満たす臨床
following conditions:
研究をいう
(a) the assignment of the subject to a particular
(a) 特定の治療法への被験者の割り付けが、あらかじ
therapeutic strategy is decided in advance and does
め決められており、当該加盟国の通常の診療の
not fall within normal clinical practice of the Member
範囲内ではない
State concerned;
(b) the decision to prescribe the investigational medicinal
(b) 試験薬処方の意思決定は、被験者を臨床研究に
products is taken together with the decision to
登録する意思決定に伴って行われる
include the subject in the clinical study; or
(c) diagnostic or monitoring procedures in addition to
(c) 被験者に対して通常の診療では行われない診断
normal clinical practice are applied to the subjects.
またはモニタリングの手法が用いられる
(3)‘Low-intervention clinical trial’ means a clinical trial which
fulfils all of the following conditions:
(3) 「低介入臨床試験」とは、以下の条件をすべて満たす臨
床試験をいう
6