よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
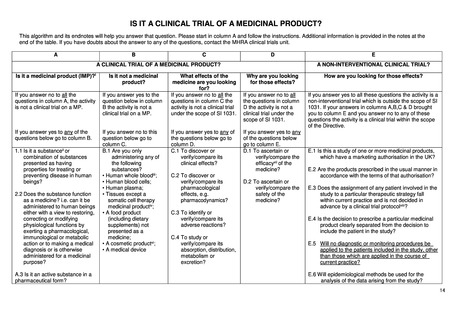
(a) the investigational medicinal products, excluding
placebos, are authorised;
(b) according to the protocol of the clinical trial,
(i) the investigational medicinal products are used in
accordance with the terms of the marketing
authorisation; or
(ii) the use of the investigational medicinal products is
evidence-based and supported by published
scientific evidence on the safety and efficacy of
those investigational medicinal products in any of
the Member States concerned; and
(c) the additional diagnostic or monitoring procedures do
not pose more than minimal additional risk or burden to
the safety of the subjects compared to normal clinical
practice in any Member State concerned;
(4)‘Non-interventional study’ means a clinical study other
than a clinical trial;
(a) 試験薬(プラセボを除く)が承認されている
(b) 臨床試験のプロトコールに沿って、
(i) 試験薬が製造販売承認の条件に従って使用され
る
(ii) 試験薬の使用が、関係加盟国のエビデンスに基
づくものであり、公表されている科学的エビデンス
によりその安全性及び有効性が支持されている
(c) 追加の診断またはモニタリングの手法が、関係加
盟国における通常の診療と比較して、被験者の安
全性に最小限以上のリスクや負担を与えない
(4) 「非介入研究」とは、臨床試験以外の臨床研究をいう
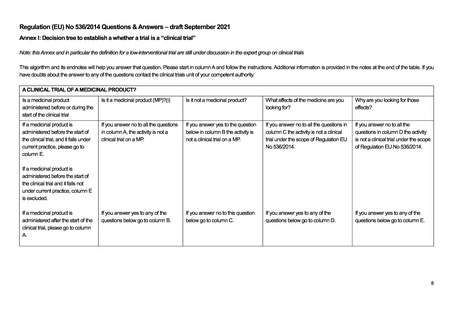
なお、EU-CTR の対象となるか否かのドラフト版のディシジョンツリーが EU-CTR Q&A として公開されている。このディシジ
ョンツリーを次ページ以降に示すが、EU-CTR の施行前に公表されたドラフト版であり、正式に発行されものではないことに注
意が必要である。
<参考文献>
REGULATION (EU) No 536/2014 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 16 April 2014 on clinical
trials on medicinal products for human use
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=celex%3A32014R0536
The rules governing medicinal products in the European Union. VOLUME 10 - Guidance documents applying to clinical trials.
CLINICAL TRIALS REGULATION (EU) NO 536/2014. DRAFT QUESTIONS & ANSWERS. VERSION 4.1
https://ec.europa.eu/health/sites/default/files/files/eudralex/vol-10/regulation5362014_qa_en.pdf
7
placebos, are authorised;
(b) according to the protocol of the clinical trial,
(i) the investigational medicinal products are used in
accordance with the terms of the marketing
authorisation; or
(ii) the use of the investigational medicinal products is
evidence-based and supported by published
scientific evidence on the safety and efficacy of
those investigational medicinal products in any of
the Member States concerned; and
(c) the additional diagnostic or monitoring procedures do
not pose more than minimal additional risk or burden to
the safety of the subjects compared to normal clinical
practice in any Member State concerned;
(4)‘Non-interventional study’ means a clinical study other
than a clinical trial;
(a) 試験薬(プラセボを除く)が承認されている
(b) 臨床試験のプロトコールに沿って、
(i) 試験薬が製造販売承認の条件に従って使用され
る
(ii) 試験薬の使用が、関係加盟国のエビデンスに基
づくものであり、公表されている科学的エビデンス
によりその安全性及び有効性が支持されている
(c) 追加の診断またはモニタリングの手法が、関係加
盟国における通常の診療と比較して、被験者の安
全性に最小限以上のリスクや負担を与えない
(4) 「非介入研究」とは、臨床試験以外の臨床研究をいう
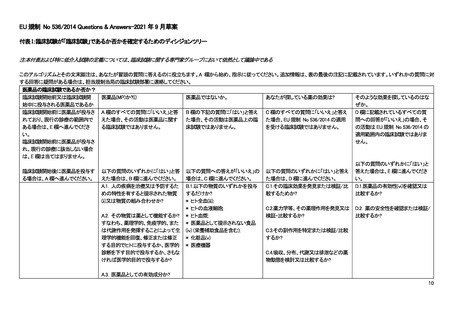
なお、EU-CTR の対象となるか否かのドラフト版のディシジョンツリーが EU-CTR Q&A として公開されている。このディシジ
ョンツリーを次ページ以降に示すが、EU-CTR の施行前に公表されたドラフト版であり、正式に発行されものではないことに注
意が必要である。
<参考文献>
REGULATION (EU) No 536/2014 OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 16 April 2014 on clinical
trials on medicinal products for human use
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=celex%3A32014R0536
The rules governing medicinal products in the European Union. VOLUME 10 - Guidance documents applying to clinical trials.
CLINICAL TRIALS REGULATION (EU) NO 536/2014. DRAFT QUESTIONS & ANSWERS. VERSION 4.1
https://ec.europa.eu/health/sites/default/files/files/eudralex/vol-10/regulation5362014_qa_en.pdf
7