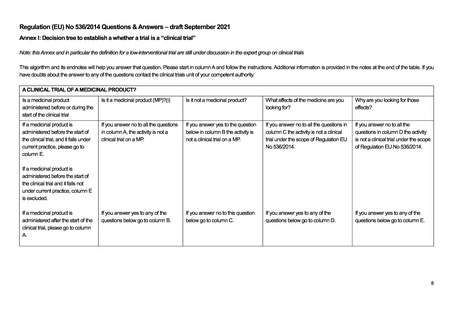
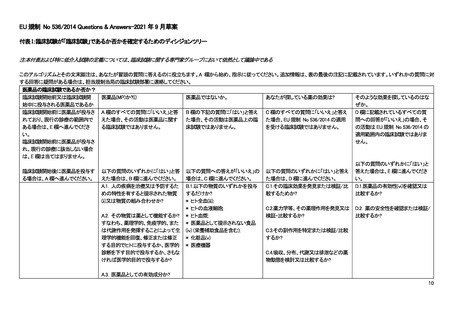
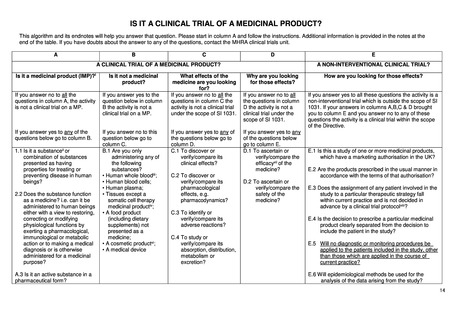
よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
as a well-controlled study in support of a new indication
for use nor intended to be used to support any other
significant change in the labeling for the drug;
(ii) If the drug that is undergoing investigation is lawfully
marketed as a prescription drug product, the
investigation is not intended to support a significant
change in the advertising for the product;
(iii) The investigation does not involve a route of
administration or dosage level or use in a patient
population or other factor that significantly increases the
risks (or decreases the acceptability of the risks)
associated with the use of the drug product;
(iv) The investigation is conducted in compliance with the
requirements for institutional review set forth in part 56
and with the requirements for informed consent set forth
in part 50; and
(v) The investigation is conducted in compliance with the
requirements of § 312.7.
§ 312.3 Definitions and interpretations.
Clinical investigation means any experiment in which a drug is
administered or dispensed to, or used involving, one or more
human subjects. For the purposes of this part, an experiment
is any use of a drug except for the use of a marketed drug in
the course of medical practice.
れた試験として FDA に報告されることを意図しておら
ず、また、医薬品のラベリングにおけるその他の重要
な変更を裏付けるために使用されることを意図してい
ない。
(ii) 対象となっている医薬品が処方箋医薬品として合法的
に販売されている場合、当該研究は当該製品の広告
の重要な変更を裏付けることを意図していないこと。
(iii) 研究が、投与経路、投与量、患者集団での使用など、
医薬品の使用に伴うリスクを著しく増加させる(または
リスクの許容範囲を減少させる)要因を含んでいない
こと。
(iv) 研究が、パート 56 に定められた機関審査の要件およ
びパート 50 に定められたインフォームド・コン セント
の要件を遵守して実施されていること。
(v) 研究が、§312.7 の要件に準拠して実施される。
Investigational new drug means a new drug or biological drug
that is used in a clinical investigation. The term also includes a
biological product that is used in vitro for diagnostic purposes.
The terms “investigational drug” and “investigational new
drug” are deemed to be synonymous for purposes of this part.
研究用新薬(investigational new drug)とは、臨床研究に使用
される新薬または生物学的製剤をいう。また、診断を目的と
して体外で使用される生物学的製剤も含まれる。本パート
では、「治験薬」および「治験用新薬」という用語は同義語と
みなされる。
§ 312.3 定義および解釈
臨床研究(clinical investigation)とは、1 人以上の被験者に薬
剤を投与・調剤したり、使用したりする実験(experiment)を意
味する。このパートの目的では、実験とは、医療行為の過
程で市販されている医薬品を使用することを除く、医薬品の
あらゆる使用を指す。
3) 医療機器に関する規制
米国で医療機器の有効性、安全性を評価しようとする臨床試験を行おうとする場合、重要なリスクのある機器については
FDA に対して IDE(Investigational Device Exemption)申請を行う必要がある。IDE 申請を行うことで、医療機器の薬事承認取得
等の規制が免除された形で臨床試験で医療機器を用いることが可能となる。ここで重要なリスクとは概ねクラス III の一部とク
ラス IV に該当する。IDE 申請は未承認で重要なリスクのある医療機器を対象にしており、市販後の医療機器を用いた臨床試
験は対象外である。
一方、これらに該当しないクラス I、II、III の医療機器については IDE 申請不要で、臨床試験なしに市販のための承認を得る
道が用意されている。典型的には 510(k)と呼ばれる市販前申請を提出し、これらの有効性や安全性が市販されている医療機
器と実施的に同程度であることを FDA に示し製造販売承認を得るというプロセスを経る。つまり、米国では医療機器のリスク
に応じて規制の強さが変えられている。これは日本における一般医療機器、指定管理医療機器、高度管理医療機器の別に類
似しているものと言える。また、クラス I、II に分類される新型医療機器で同等性の比較が可能な機器が存在しない場合の市
販のための申請方法として De Novo 申請と言われる申請法がある。
3
for use nor intended to be used to support any other
significant change in the labeling for the drug;
(ii) If the drug that is undergoing investigation is lawfully
marketed as a prescription drug product, the
investigation is not intended to support a significant
change in the advertising for the product;
(iii) The investigation does not involve a route of
administration or dosage level or use in a patient
population or other factor that significantly increases the
risks (or decreases the acceptability of the risks)
associated with the use of the drug product;
(iv) The investigation is conducted in compliance with the
requirements for institutional review set forth in part 56
and with the requirements for informed consent set forth
in part 50; and
(v) The investigation is conducted in compliance with the
requirements of § 312.7.
§ 312.3 Definitions and interpretations.
Clinical investigation means any experiment in which a drug is
administered or dispensed to, or used involving, one or more
human subjects. For the purposes of this part, an experiment
is any use of a drug except for the use of a marketed drug in
the course of medical practice.
れた試験として FDA に報告されることを意図しておら
ず、また、医薬品のラベリングにおけるその他の重要
な変更を裏付けるために使用されることを意図してい
ない。
(ii) 対象となっている医薬品が処方箋医薬品として合法的
に販売されている場合、当該研究は当該製品の広告
の重要な変更を裏付けることを意図していないこと。
(iii) 研究が、投与経路、投与量、患者集団での使用など、
医薬品の使用に伴うリスクを著しく増加させる(または
リスクの許容範囲を減少させる)要因を含んでいない
こと。
(iv) 研究が、パート 56 に定められた機関審査の要件およ
びパート 50 に定められたインフォームド・コン セント
の要件を遵守して実施されていること。
(v) 研究が、§312.7 の要件に準拠して実施される。
Investigational new drug means a new drug or biological drug
that is used in a clinical investigation. The term also includes a
biological product that is used in vitro for diagnostic purposes.
The terms “investigational drug” and “investigational new
drug” are deemed to be synonymous for purposes of this part.
研究用新薬(investigational new drug)とは、臨床研究に使用
される新薬または生物学的製剤をいう。また、診断を目的と
して体外で使用される生物学的製剤も含まれる。本パート
では、「治験薬」および「治験用新薬」という用語は同義語と
みなされる。
§ 312.3 定義および解釈
臨床研究(clinical investigation)とは、1 人以上の被験者に薬
剤を投与・調剤したり、使用したりする実験(experiment)を意
味する。このパートの目的では、実験とは、医療行為の過
程で市販されている医薬品を使用することを除く、医薬品の
あらゆる使用を指す。
3) 医療機器に関する規制
米国で医療機器の有効性、安全性を評価しようとする臨床試験を行おうとする場合、重要なリスクのある機器については
FDA に対して IDE(Investigational Device Exemption)申請を行う必要がある。IDE 申請を行うことで、医療機器の薬事承認取得
等の規制が免除された形で臨床試験で医療機器を用いることが可能となる。ここで重要なリスクとは概ねクラス III の一部とク
ラス IV に該当する。IDE 申請は未承認で重要なリスクのある医療機器を対象にしており、市販後の医療機器を用いた臨床試
験は対象外である。
一方、これらに該当しないクラス I、II、III の医療機器については IDE 申請不要で、臨床試験なしに市販のための承認を得る
道が用意されている。典型的には 510(k)と呼ばれる市販前申請を提出し、これらの有効性や安全性が市販されている医療機
器と実施的に同程度であることを FDA に示し製造販売承認を得るというプロセスを経る。つまり、米国では医療機器のリスク
に応じて規制の強さが変えられている。これは日本における一般医療機器、指定管理医療機器、高度管理医療機器の別に類
似しているものと言える。また、クラス I、II に分類される新型医療機器で同等性の比較が可能な機器が存在しない場合の市
販のための申請方法として De Novo 申請と言われる申請法がある。
3