よむ、つかう、まなぶ。
参考資料1-2: 令和3年度厚生労働科学特別研究事業「臨床研究法の見直しの審議における新たな課題・論点への対応策の確立のための研究」班 欧米での観察研究の取り扱い (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24643.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第29回 3/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
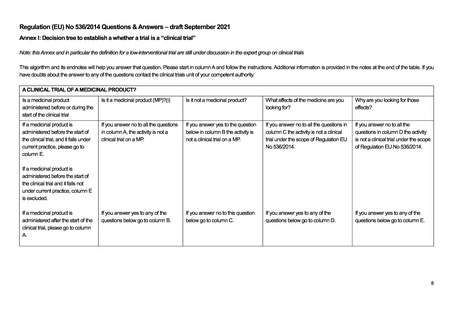
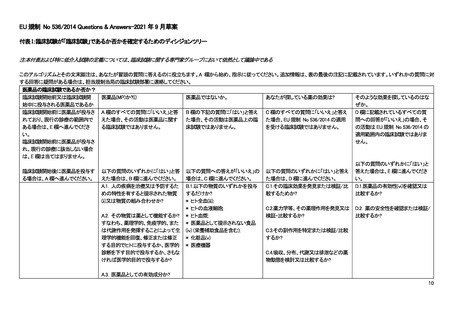
4.
ICH-E6/E8 ガイドライン
臨床試験で遵守すべき指針として ICH-E6(R2)ガイドライン、いわゆる ICH-GCP がよく知られている。この ICH-E6 は、薬
事規制当局に提出される臨床試験(clinical trial)のデータを作成する際に従うべきガイドラインとされている一方で、その原則
は他の臨床研究(clinical investigation)にも適用され得ると書かれている。一方で、ICH-E6 と対になるガイドラインとして知られ
ている「ICH-E8(R1):臨床試験の一般原則」では、医学的介入を伴う臨床研究(clinical studies of medical interventions)がスコー
プで、その中でも特に医薬品(product)を対象にしていると書かれている。つまり、ICH-E6/E8 ガイドラインの対象は医薬品を
対象とした介入研究である。事実、現在進行中の GCP renovation と呼ばれる ICH-E6 と E8 の改訂作業部会の公聴会でも、
ICH-E6 の対象は”interventional studies for medical products”であると明言されており、医薬品の非介入研究は対象に含まれ
ない。
ICH-E6(R2):Good Clinical Practice (GCP)
原文
Introduction
This guideline should be followed when generating clinical trial
data that are intended to be submitted to regulatory
authorities.
ICH-E6(R2):Good Clinical Practice (GCP)
1.12 Clinical Trial/Study
Any investigation in human subjects intended to discover or
verify the clinical, pharmacological and/or other
pharmacodynamic effects of an investigational product(s),
and/or to identify any adverse reactions to an investigational
product(s), and/or to study absorption, distribution,
metabolism, and excretion of an investigational product(s) with
the object of ascertaining its safety and/or efficacy. The terms
clinical trial and clinical study are synonymous.
日本語訳
イントロダクション
本ガイドラインは,規制当局に提出する臨床試験のデータ
を作成する際に従うべきものである。
1.12 臨床試験/研究
人を対象とする研究で,①被験薬の臨床的,薬理学的及び
(又は)その他の薬力学的効果の検出又は確認,②被験薬
の副作用の確認,③被験薬の安全性及び(又は)有効性を
確認するための被験薬の吸収,分布,代謝及び排泄の検
討等を目的とするもの(Clinical trial と Clinical study は同義
語)
ICH-E8(R1):General Consideration for Clinical Studies(臨床試験の一般原則)
原文
日本語訳
1. Objective of this document
1. 本指針の目的
Clinical studies of medical interventions are conducted to 医学的介入としての臨床試験は、試験に参加する被験者を
provide information that can ultimately improve access to safe 保護しながら、最終的には患者に対して意味のある影響を
and effective drugs with meaningful impact on patients, while 持つ安全かつ有効な医薬品へのアクセスを改善するため
protecting those participating in the studies. This document の情報を提供するために実施される。本指針では、薬事規
focuses on designing quality into clinical studies, considering 制やその他の健康政策における意思決定を支援するため
the diversity of clinical study designs and data sources used to に用いられる臨床試験デザイン及びデータソースの多様性
support regulatory and other health policy decisions.
を考慮して、臨床試験における質の設計に焦点を当ててい
る。
The ICH document "General Considerations for Clinical ICH 文書である「臨床試験の一般指針」は、以下を目的とし
Studies" is intended to:
ている。
1. Describe internationally accepted principles and 1. 規制当局によるデータと結果の受け入れを促進する、
practices in the design and conduct of clinical studies
臨床試験のデザインと実施に関する国際的に受け入
that will facilitate acceptance of data and results by
れられる原則と具体的なあり方を記述すること。
regulatory authorities
2. 試験の計画段階での試験の質に関する重要な因子の
2. Provide guidance on the consideration of quality in the
同定と、試験実施中のそれら因子に対するリスクの管
design and conduct of clinical studies across the product
理を含む、医薬品(product)のライフサイクルを通じた
lifecycle, including the identification during study planning
臨床試験のデザインと実施に関する質の検討に関す
of factors that are critical to the quality of the study, and
る指針を提供すること。
the management of risks to those factors during study
conduct.
19
ICH-E6/E8 ガイドライン
臨床試験で遵守すべき指針として ICH-E6(R2)ガイドライン、いわゆる ICH-GCP がよく知られている。この ICH-E6 は、薬
事規制当局に提出される臨床試験(clinical trial)のデータを作成する際に従うべきガイドラインとされている一方で、その原則
は他の臨床研究(clinical investigation)にも適用され得ると書かれている。一方で、ICH-E6 と対になるガイドラインとして知られ
ている「ICH-E8(R1):臨床試験の一般原則」では、医学的介入を伴う臨床研究(clinical studies of medical interventions)がスコー
プで、その中でも特に医薬品(product)を対象にしていると書かれている。つまり、ICH-E6/E8 ガイドラインの対象は医薬品を
対象とした介入研究である。事実、現在進行中の GCP renovation と呼ばれる ICH-E6 と E8 の改訂作業部会の公聴会でも、
ICH-E6 の対象は”interventional studies for medical products”であると明言されており、医薬品の非介入研究は対象に含まれ
ない。
ICH-E6(R2):Good Clinical Practice (GCP)
原文
Introduction
This guideline should be followed when generating clinical trial
data that are intended to be submitted to regulatory
authorities.
ICH-E6(R2):Good Clinical Practice (GCP)
1.12 Clinical Trial/Study
Any investigation in human subjects intended to discover or
verify the clinical, pharmacological and/or other
pharmacodynamic effects of an investigational product(s),
and/or to identify any adverse reactions to an investigational
product(s), and/or to study absorption, distribution,
metabolism, and excretion of an investigational product(s) with
the object of ascertaining its safety and/or efficacy. The terms
clinical trial and clinical study are synonymous.
日本語訳
イントロダクション
本ガイドラインは,規制当局に提出する臨床試験のデータ
を作成する際に従うべきものである。
1.12 臨床試験/研究
人を対象とする研究で,①被験薬の臨床的,薬理学的及び
(又は)その他の薬力学的効果の検出又は確認,②被験薬
の副作用の確認,③被験薬の安全性及び(又は)有効性を
確認するための被験薬の吸収,分布,代謝及び排泄の検
討等を目的とするもの(Clinical trial と Clinical study は同義
語)
ICH-E8(R1):General Consideration for Clinical Studies(臨床試験の一般原則)
原文
日本語訳
1. Objective of this document
1. 本指針の目的
Clinical studies of medical interventions are conducted to 医学的介入としての臨床試験は、試験に参加する被験者を
provide information that can ultimately improve access to safe 保護しながら、最終的には患者に対して意味のある影響を
and effective drugs with meaningful impact on patients, while 持つ安全かつ有効な医薬品へのアクセスを改善するため
protecting those participating in the studies. This document の情報を提供するために実施される。本指針では、薬事規
focuses on designing quality into clinical studies, considering 制やその他の健康政策における意思決定を支援するため
the diversity of clinical study designs and data sources used to に用いられる臨床試験デザイン及びデータソースの多様性
support regulatory and other health policy decisions.
を考慮して、臨床試験における質の設計に焦点を当ててい
る。
The ICH document "General Considerations for Clinical ICH 文書である「臨床試験の一般指針」は、以下を目的とし
Studies" is intended to:
ている。
1. Describe internationally accepted principles and 1. 規制当局によるデータと結果の受け入れを促進する、
practices in the design and conduct of clinical studies
臨床試験のデザインと実施に関する国際的に受け入
that will facilitate acceptance of data and results by
れられる原則と具体的なあり方を記述すること。
regulatory authorities
2. 試験の計画段階での試験の質に関する重要な因子の
2. Provide guidance on the consideration of quality in the
同定と、試験実施中のそれら因子に対するリスクの管
design and conduct of clinical studies across the product
理を含む、医薬品(product)のライフサイクルを通じた
lifecycle, including the identification during study planning
臨床試験のデザインと実施に関する質の検討に関す
of factors that are critical to the quality of the study, and
る指針を提供すること。
the management of risks to those factors during study
conduct.
19