よむ、つかう、まなぶ。
【資料5】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[6.2MB] (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
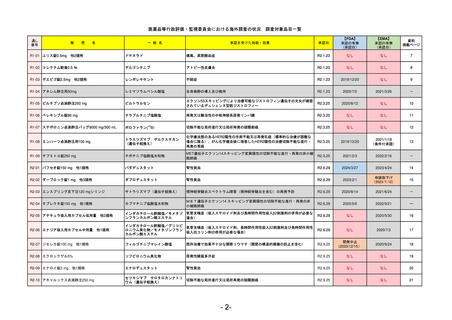
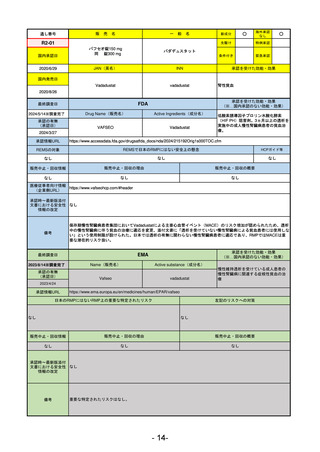
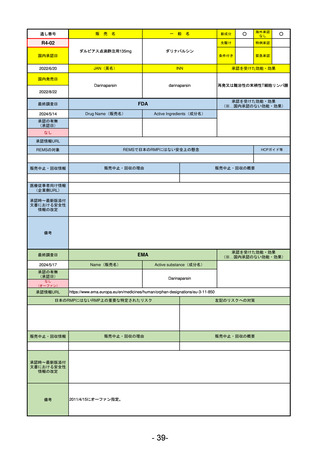
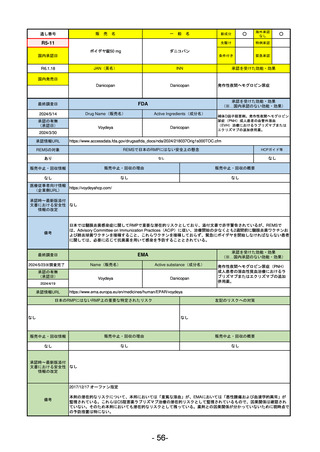
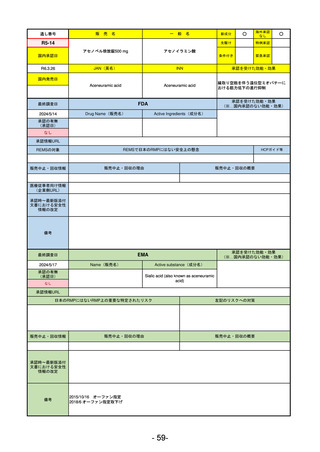
販
通し番号
売
名
一
般
新成分
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
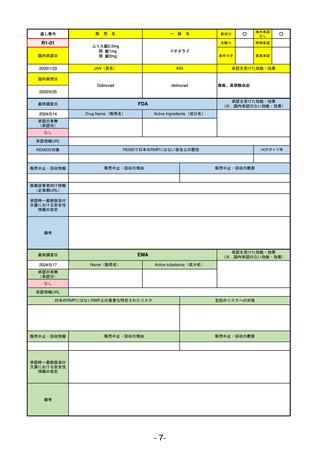
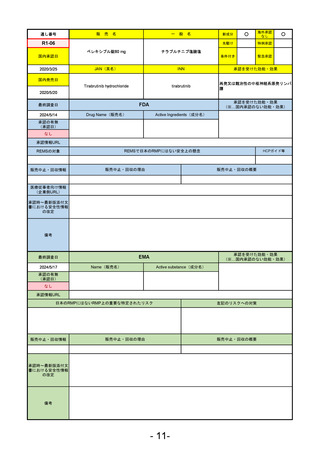
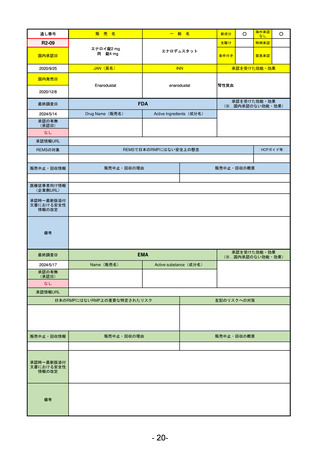
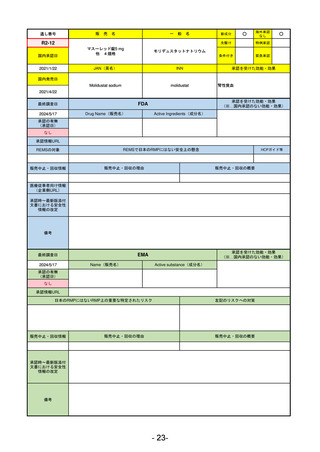
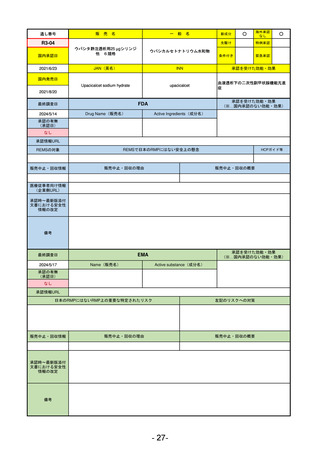
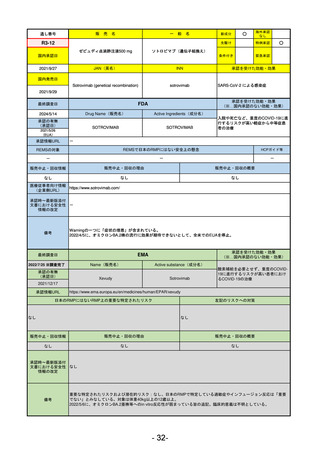
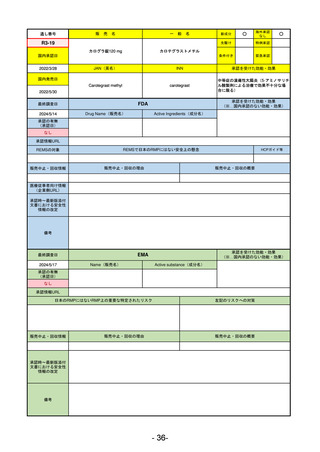
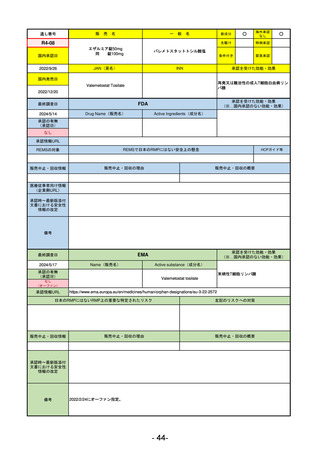
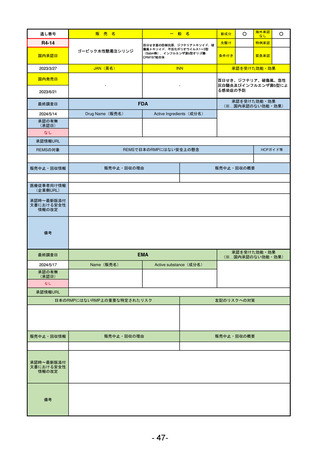
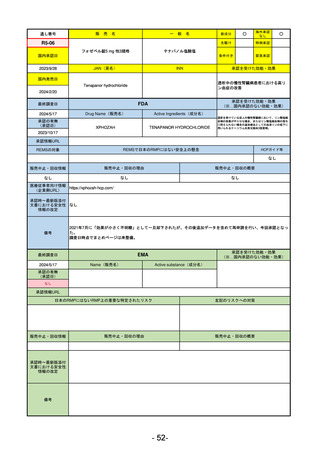
R2-02
国内承認日
2020/6/29
ダーブロック錠1 mg
他 3規格
ダプロデュスタット
JAN(英名)
INN
Daprodustat
daprodustat
承認を受けた効能・効果
国内発売日
腎性貧血
2020/8/26
承認を受けた効能・効果
(※…国内承認のない効能・効果)
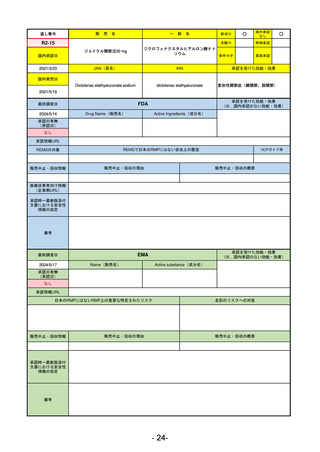
FDA
最終調査日
2023/5/26※調査完了
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
JESDUVROQ
DAPRODUSTAT
2023/2/1
承認情報URL
低酸素誘導因子プロリン水酸化酵素
(HIF PH)阻害剤で、透析を4カ月以上
受けている成人の慢性腎臓病による貧
血の治療薬
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/216951Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
(企業側URL)
https://www.jesduvroq.com/
承認時~最新版添付
文書における安全性 なし
情報の改定
前回調査時には承認されたこと及び添付文書情報のみ入手可能な状況であったことから、今回あらためて情報収集を行っ
た。
備考
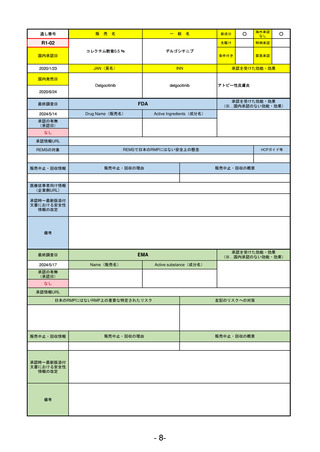
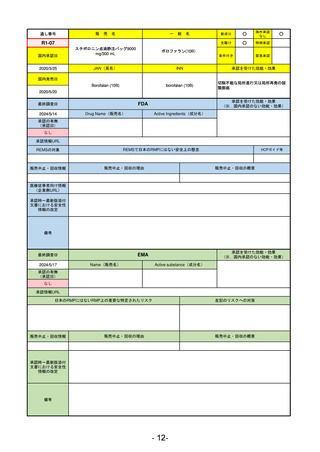
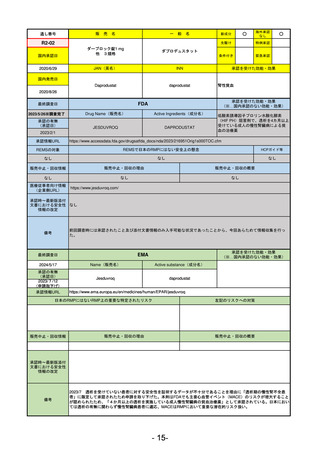
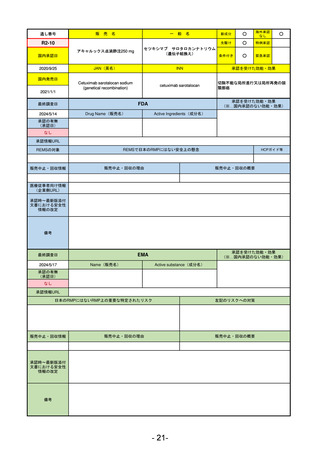
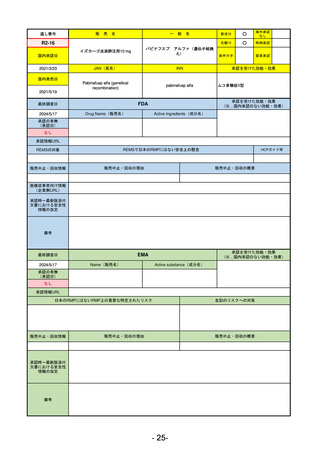
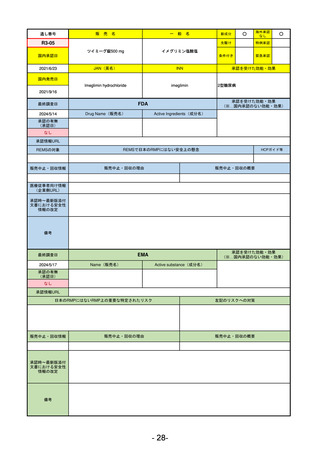
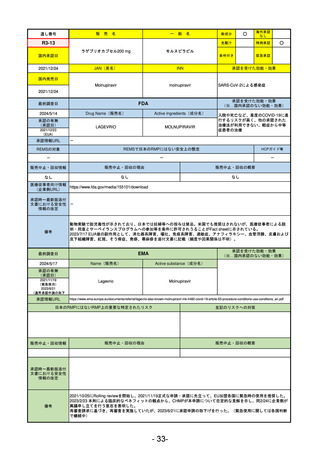
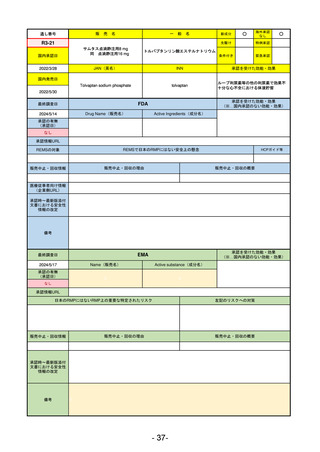
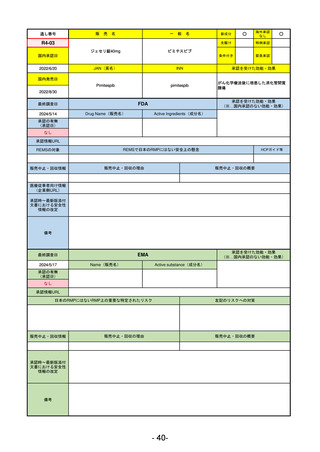
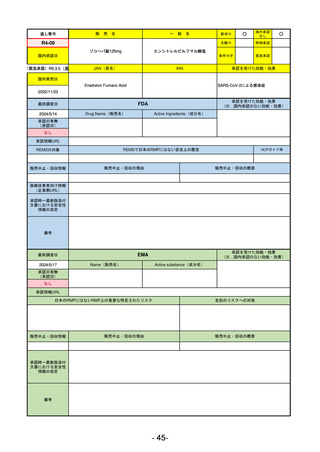
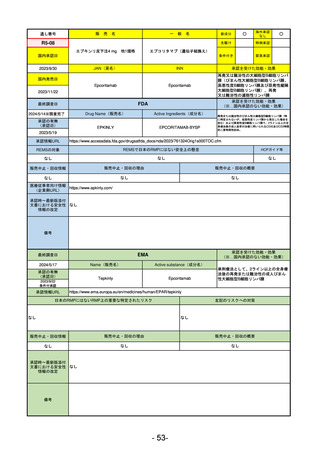
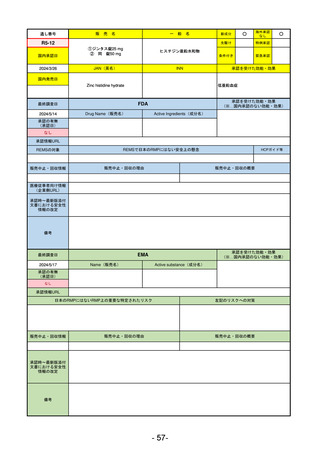
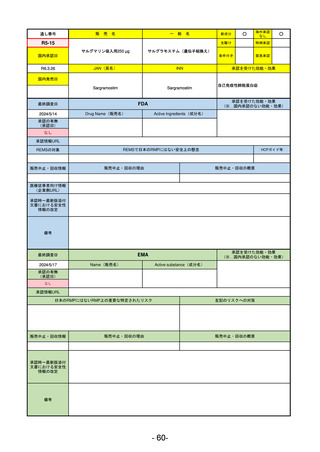
承認を受けた効能・効果
(※…国内承認のない効能・効果)
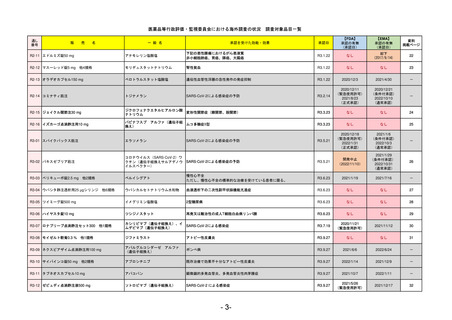
EMA
最終調査日
2024/5/17
Name(販売名)
Active substance(成分名)
承認の有無
(承認日)
2023/7/12
(申請取下げ)
Jesduvroq
daprodustat
承認情報URL
0
https://www.ema.europa.eu/en/medicines/human/EPAR/jesduvroq
日本のRMPにはないRMP上の重要な特定されたリスク
0
左記のリスクへの対策
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
承認時~最新版添付
文書における安全性 0
情報の改定
備考
2023/7 透析を受けていない患者に対する安全性を証明するデータが不十分であることを理由に「透析期の慢性腎不全患
者」に限定して承認されたため申請を取り下げた。本剤はFDAでも主要心血管イベント(MACE)のリスクが増大すること
が認められたため、「4か月以上の透析を実施している成人慢性腎臓病の貧血治療薬」として承認されている。日本におい
ては透析の有無に関わらず慢性腎臓病患者に適応、MACEはRMPにおいて重要な潜在的リスク扱い。
- 15-
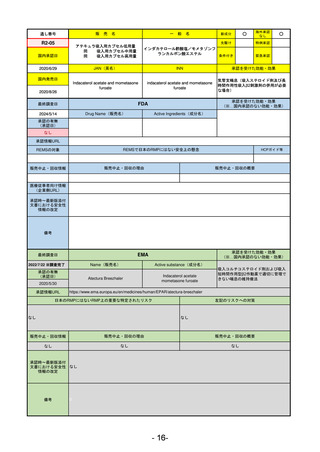
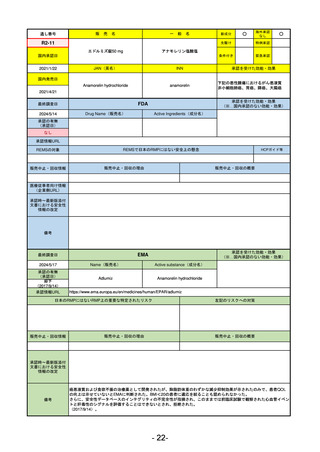
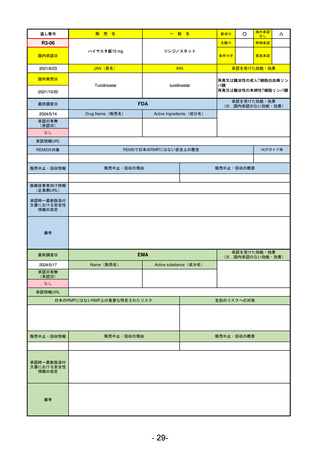
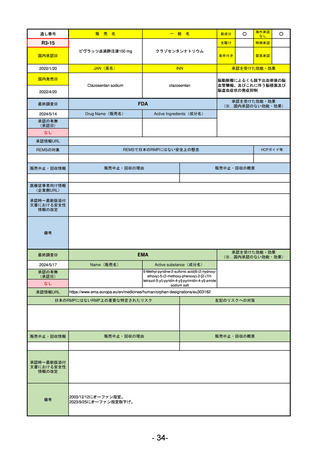
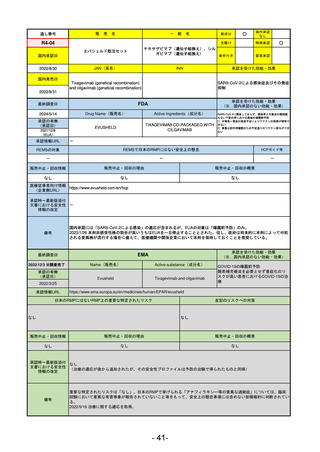
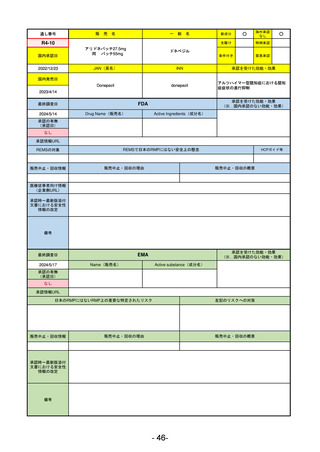
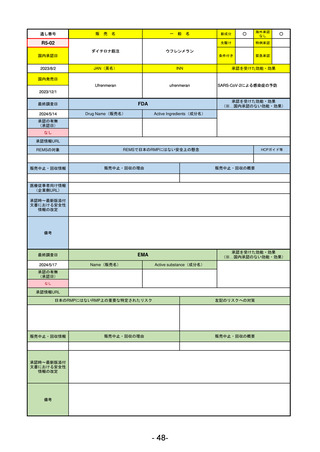
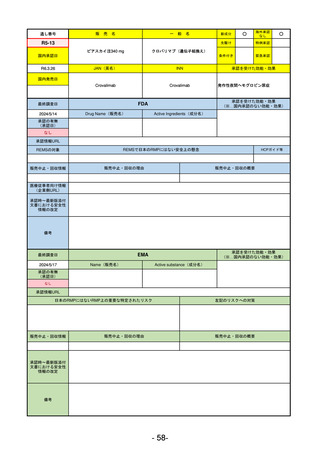
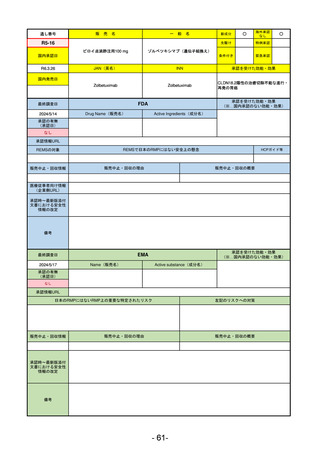
通し番号
売
名
一
般
新成分
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
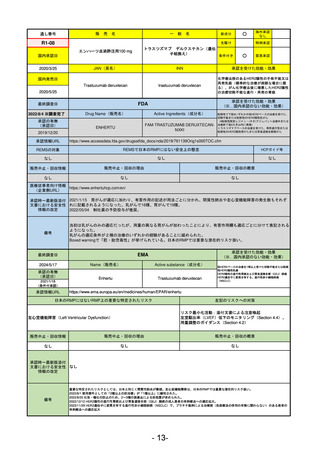
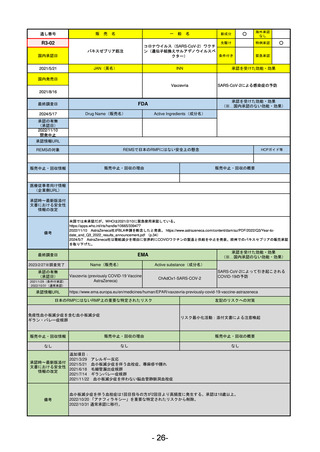
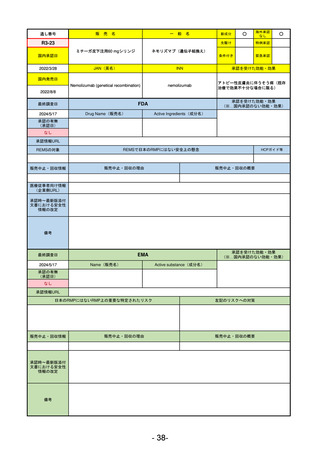
R2-02
国内承認日
2020/6/29
ダーブロック錠1 mg
他 3規格
ダプロデュスタット
JAN(英名)
INN
Daprodustat
daprodustat
承認を受けた効能・効果
国内発売日
腎性貧血
2020/8/26
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
2023/5/26※調査完了
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
JESDUVROQ
DAPRODUSTAT
2023/2/1
承認情報URL
低酸素誘導因子プロリン水酸化酵素
(HIF PH)阻害剤で、透析を4カ月以上
受けている成人の慢性腎臓病による貧
血の治療薬
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/216951Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
(企業側URL)
https://www.jesduvroq.com/
承認時~最新版添付
文書における安全性 なし
情報の改定
前回調査時には承認されたこと及び添付文書情報のみ入手可能な状況であったことから、今回あらためて情報収集を行っ
た。
備考
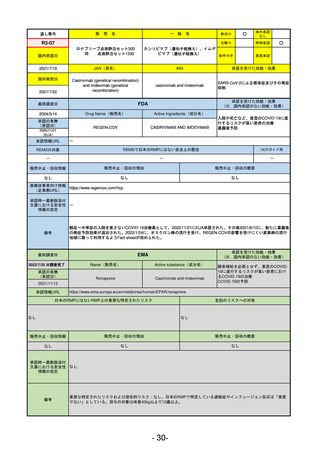
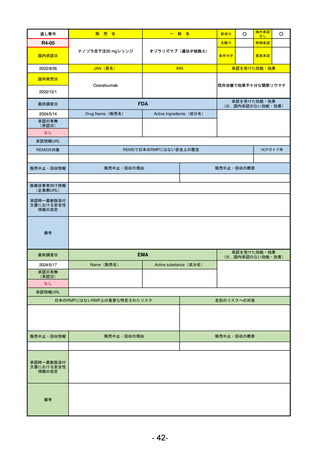
承認を受けた効能・効果
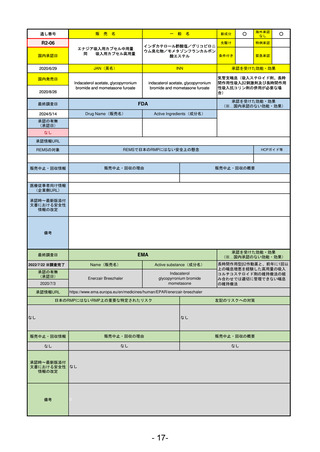
(※…国内承認のない効能・効果)
EMA
最終調査日
2024/5/17
Name(販売名)
Active substance(成分名)
承認の有無
(承認日)
2023/7/12
(申請取下げ)
Jesduvroq
daprodustat
承認情報URL
0
https://www.ema.europa.eu/en/medicines/human/EPAR/jesduvroq
日本のRMPにはないRMP上の重要な特定されたリスク
0
左記のリスクへの対策
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
承認時~最新版添付
文書における安全性 0
情報の改定
備考
2023/7 透析を受けていない患者に対する安全性を証明するデータが不十分であることを理由に「透析期の慢性腎不全患
者」に限定して承認されたため申請を取り下げた。本剤はFDAでも主要心血管イベント(MACE)のリスクが増大すること
が認められたため、「4か月以上の透析を実施している成人慢性腎臓病の貧血治療薬」として承認されている。日本におい
ては透析の有無に関わらず慢性腎臓病患者に適応、MACEはRMPにおいて重要な潜在的リスク扱い。
- 15-