よむ、つかう、まなぶ。
【資料5】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[6.2MB] (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
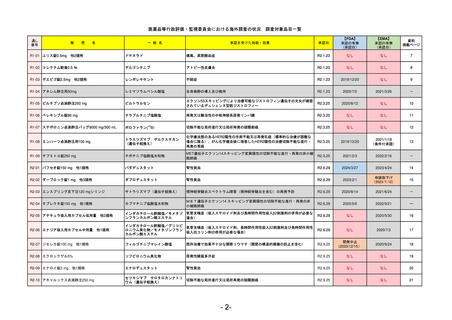
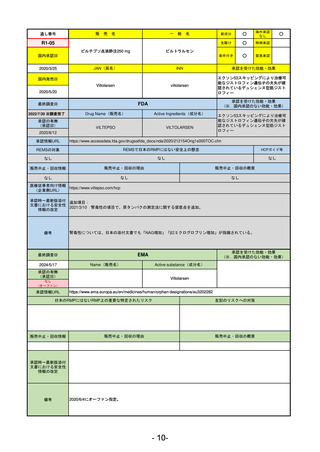
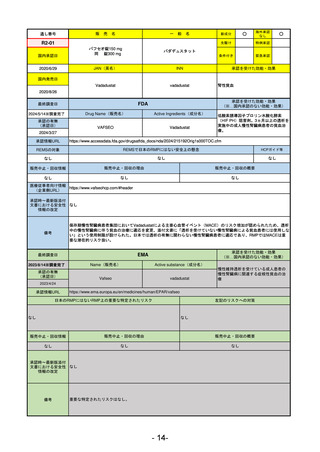
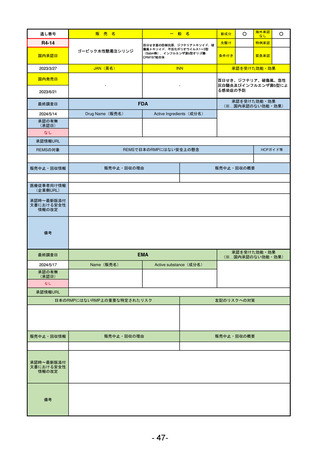
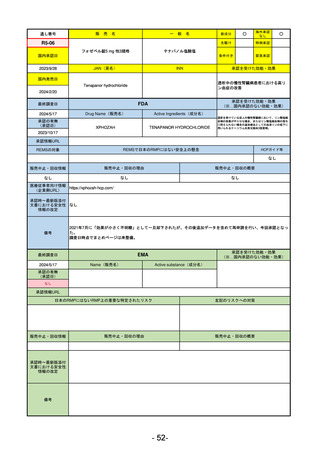
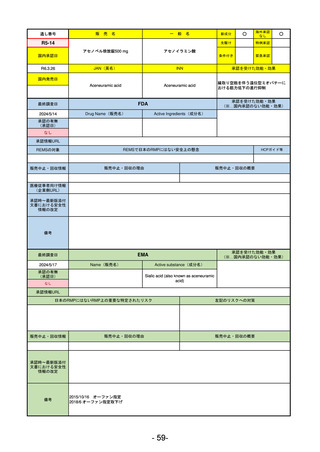
販
通し番号
売
名
一
般
新成分
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
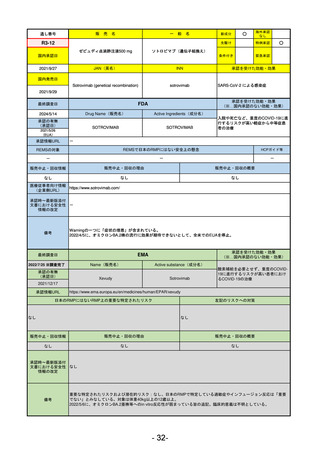
名
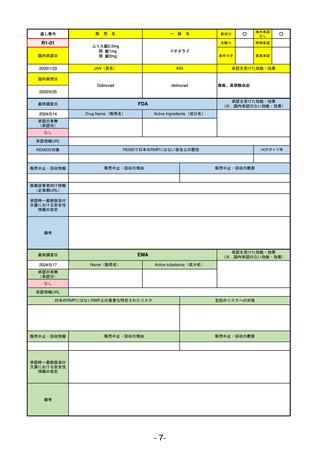
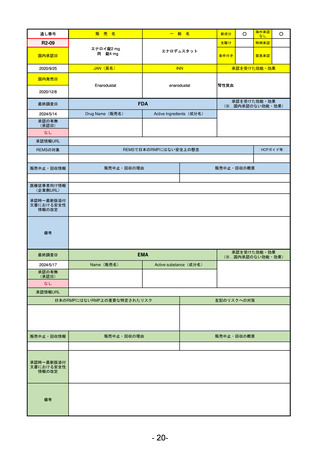
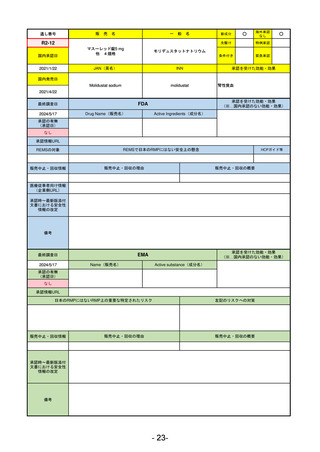
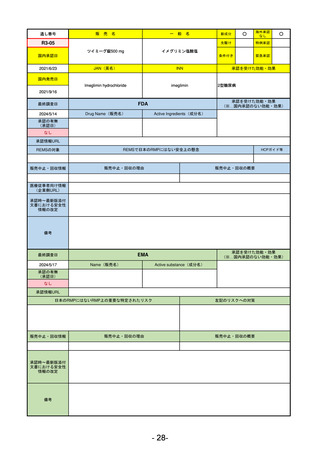
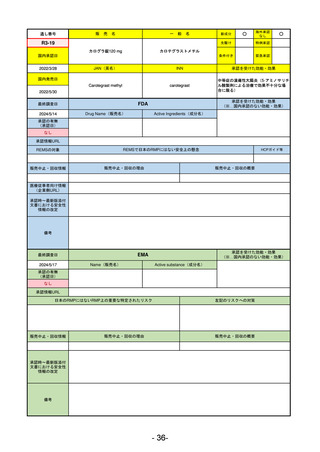
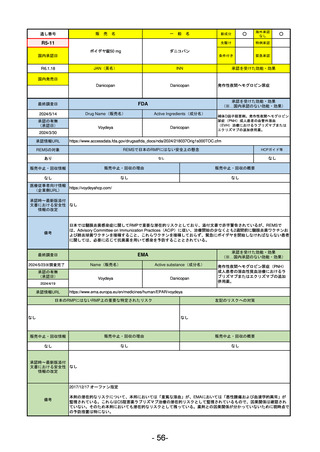
R2-11
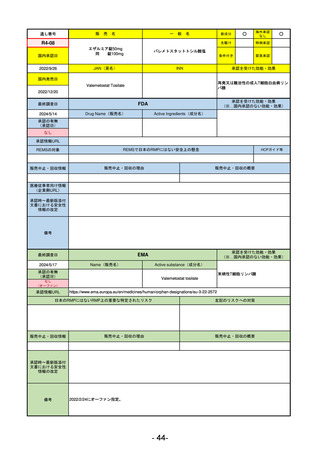
エドルミズ錠50 mg
アナモレリン塩酸塩
国内承認日
2021/1/22
JAN(英名)
INN
Anamorelin hydrochloride
anamorelin
国内発売日
承認を受けた効能・効果
下記の悪性腫瘍におけるがん悪液質
非小細胞肺癌、胃癌、膵癌、大腸癌
2021/4/21
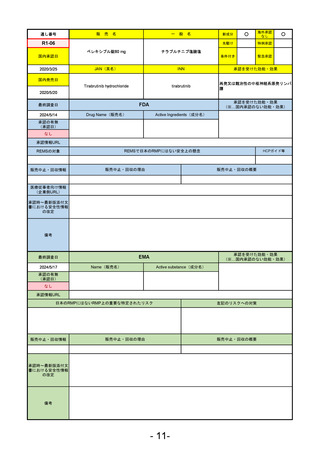
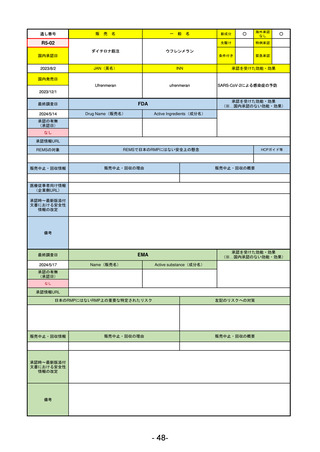
承認を受けた効能・効果
(※…国内承認のない効能・効果)
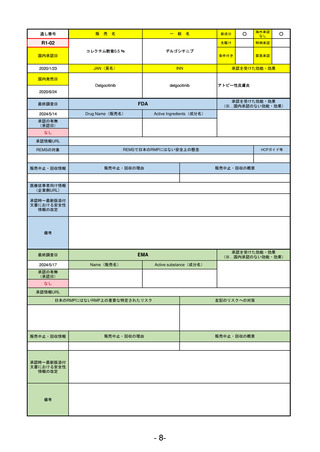
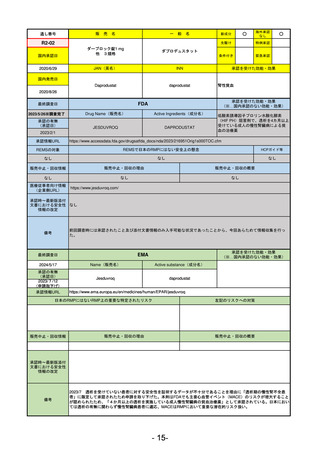
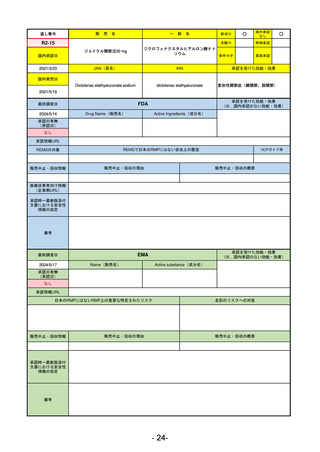
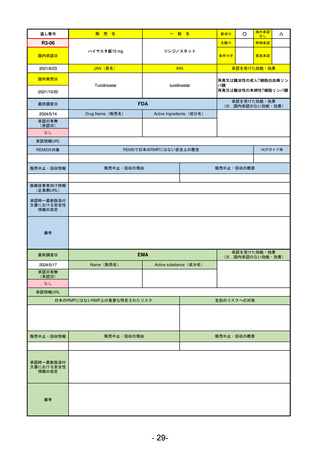
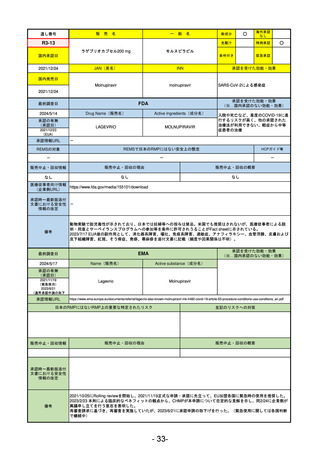
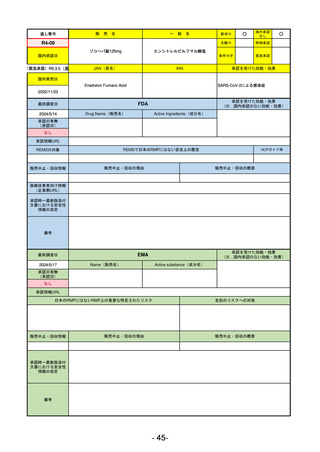
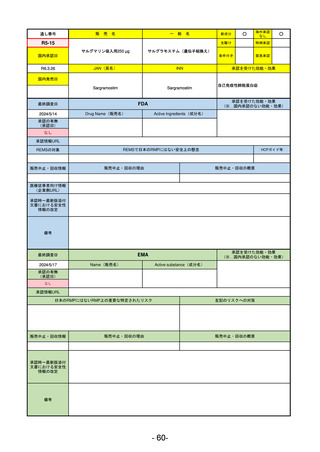
FDA
最終調査日
Drug Name(販売名)
2024/5/14
Active Ingredients(成分名)
承認の有無
(承認日)
0
0
なし
承認情報URL
0
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
0
0
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
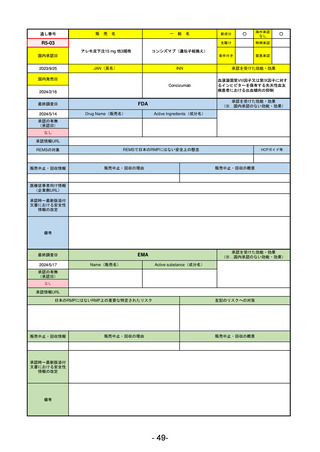
医療従事者向け情報
(企業側URL)
承認時~最新版添付
文書における安全性 0
情報の改定
備考
0
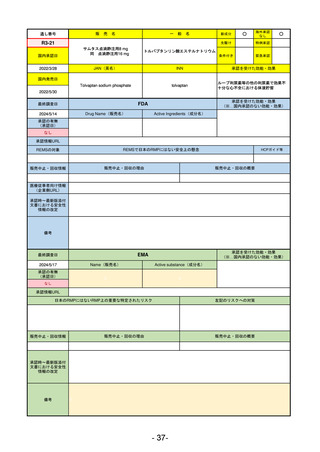
承認を受けた効能・効果
(※…国内承認のない効能・効果)
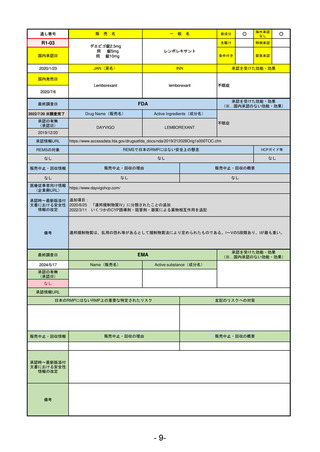
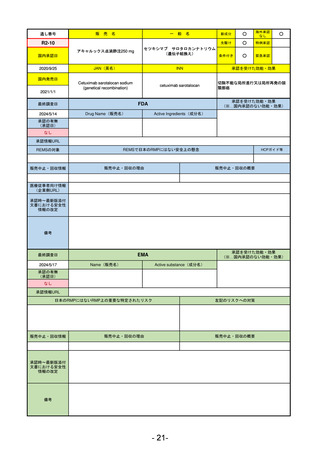
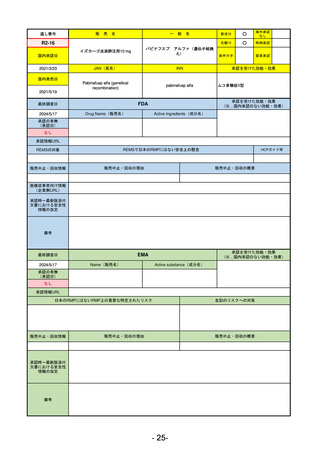
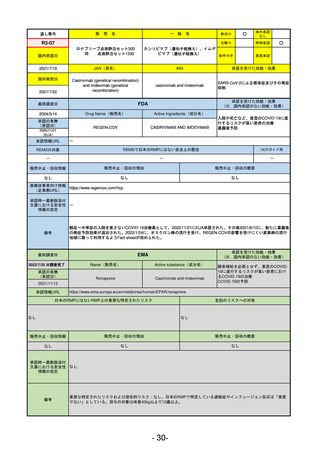
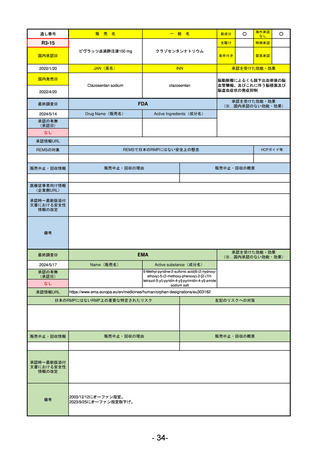
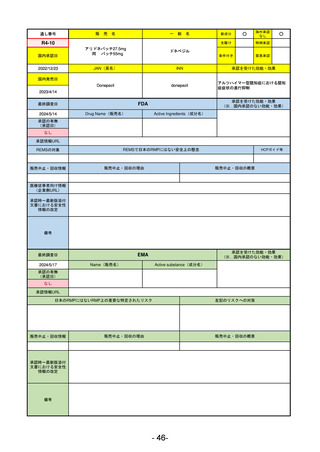
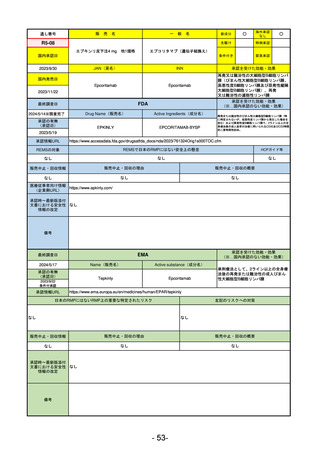
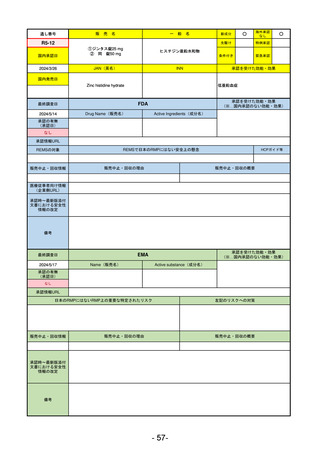
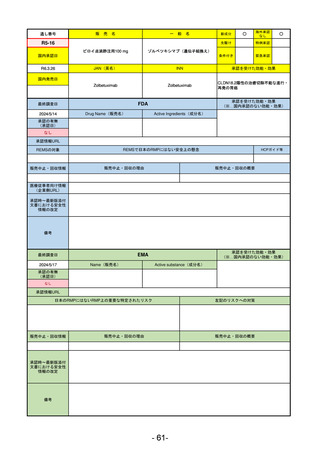
EMA
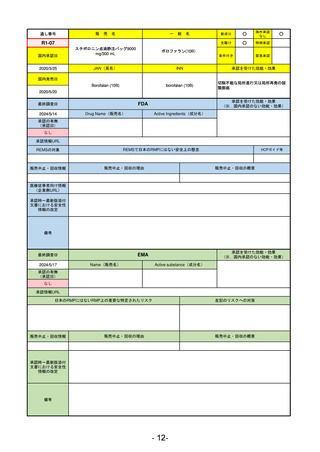
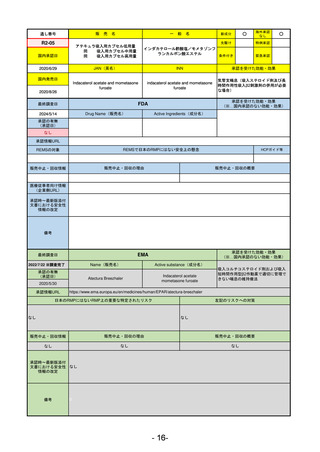
最終調査日
2024/5/17
Name(販売名)
Active substance(成分名)
承認の有無
(承認日)
却下
(2017/9/14)
Adlumiz
Anamorelin hydrochloride
承認情報URL
0
https://www.ema.europa.eu/en/medicines/human/EPAR/adlumiz
日本のRMPにはないRMP上の重要な特定されたリスク
0
左記のリスクへの対策
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
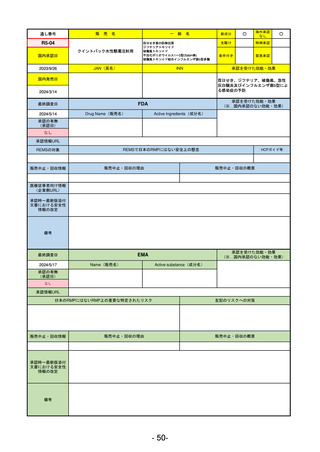
承認時~最新版添付
文書における安全性 0
情報の改定
備考
癌悪液質および食欲不振の治療薬として開発されたが、除脂肪体重のわずかな減少抑制効果が示されたのみで、患者QOL
の向上は示せていないとEMAに判断された。BMI<20の患者に適応を絞ることも認められなかった。
さらに、安全性データベースのインテグリティの不完全性が指摘され、このままでは前臨床試験で観察された心血管イベン
トと肝毒性のシグナルを評価することはできないとされ、拒絶された。
(2017/9/14)。
- 22-
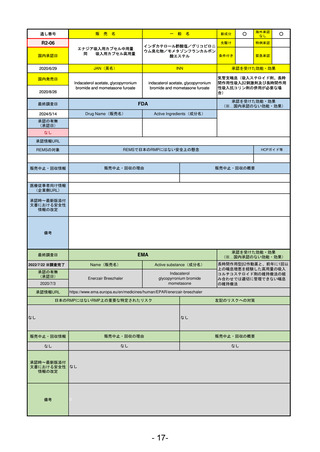
通し番号
売
名
一
般
新成分
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
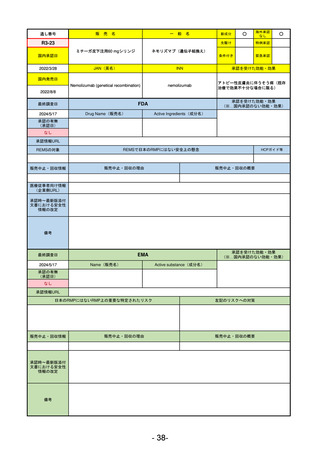
R2-11
エドルミズ錠50 mg
アナモレリン塩酸塩
国内承認日
2021/1/22
JAN(英名)
INN
Anamorelin hydrochloride
anamorelin
国内発売日
承認を受けた効能・効果
下記の悪性腫瘍におけるがん悪液質
非小細胞肺癌、胃癌、膵癌、大腸癌
2021/4/21
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
Drug Name(販売名)
2024/5/14
Active Ingredients(成分名)
承認の有無
(承認日)
0
0
なし
承認情報URL
0
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
0
0
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
医療従事者向け情報
(企業側URL)
承認時~最新版添付
文書における安全性 0
情報の改定
備考
0
承認を受けた効能・効果
(※…国内承認のない効能・効果)
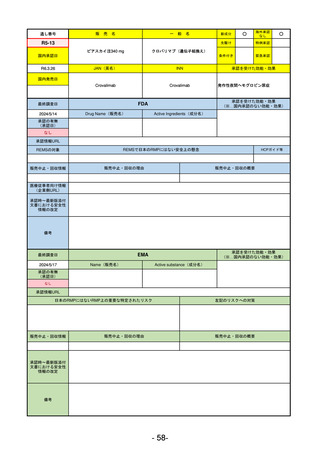
EMA
最終調査日
2024/5/17
Name(販売名)
Active substance(成分名)
承認の有無
(承認日)
却下
(2017/9/14)
Adlumiz
Anamorelin hydrochloride
承認情報URL
0
https://www.ema.europa.eu/en/medicines/human/EPAR/adlumiz
日本のRMPにはないRMP上の重要な特定されたリスク
0
左記のリスクへの対策
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
承認時~最新版添付
文書における安全性 0
情報の改定
備考
癌悪液質および食欲不振の治療薬として開発されたが、除脂肪体重のわずかな減少抑制効果が示されたのみで、患者QOL
の向上は示せていないとEMAに判断された。BMI<20の患者に適応を絞ることも認められなかった。
さらに、安全性データベースのインテグリティの不完全性が指摘され、このままでは前臨床試験で観察された心血管イベン
トと肝毒性のシグナルを評価することはできないとされ、拒絶された。
(2017/9/14)。
- 22-