よむ、つかう、まなぶ。
【資料5】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[6.2MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
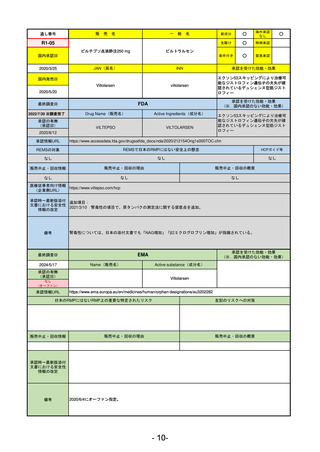
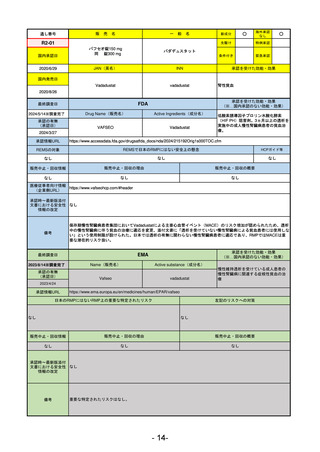
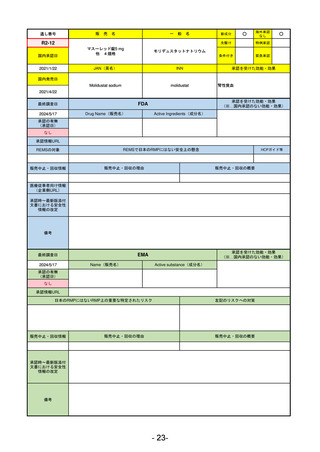
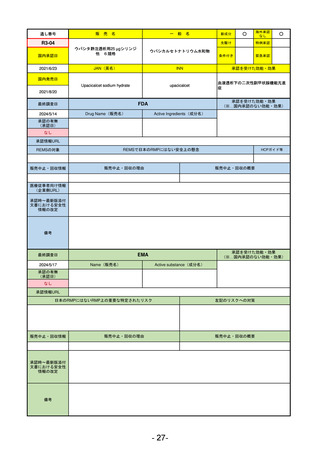
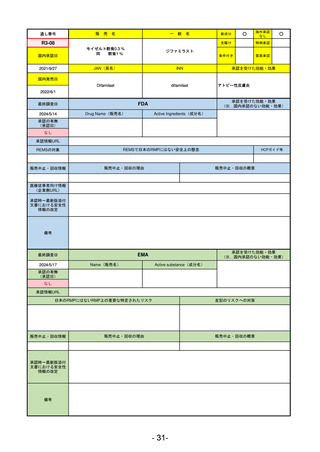
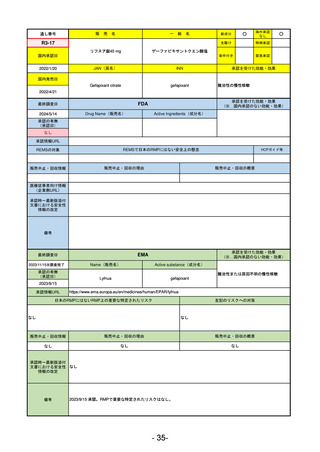
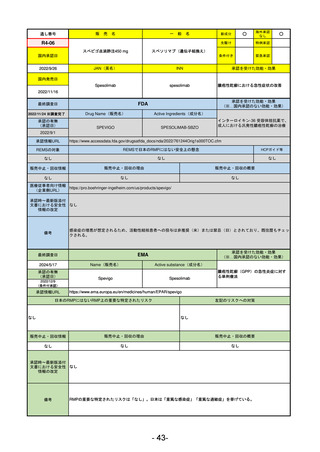
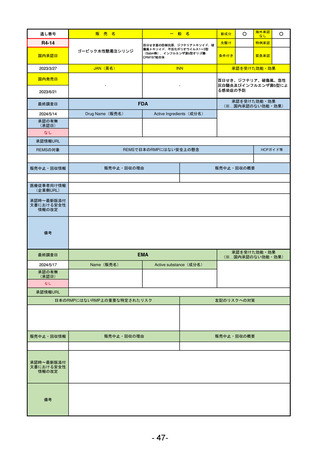
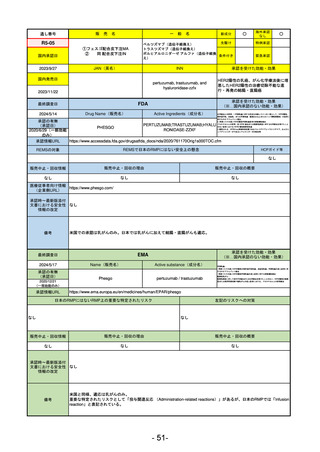
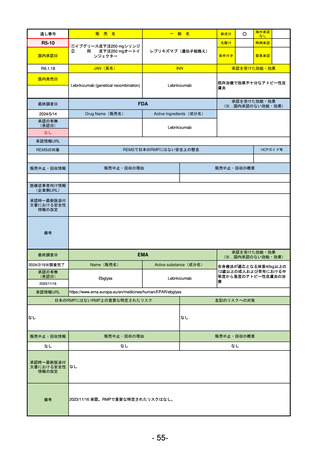
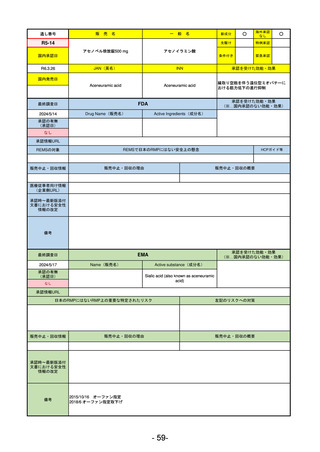
医薬品等行政評価・監視委員会における海外調査の状況
通し
番号
販
売
名
一 般 名
調査対象品目一覧
承認を受けた効能・効果
承認日
【FDA】
承認の有無
(承認日)
【EMA】
承認の有無
(承認日)
資料
掲載ページ
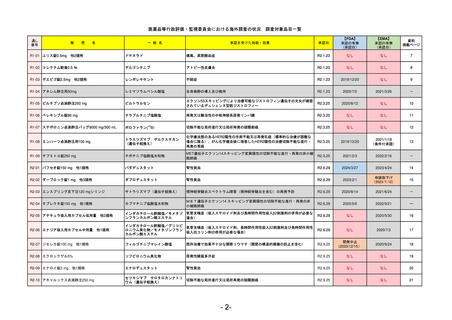
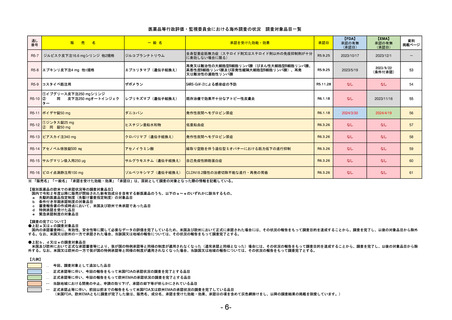
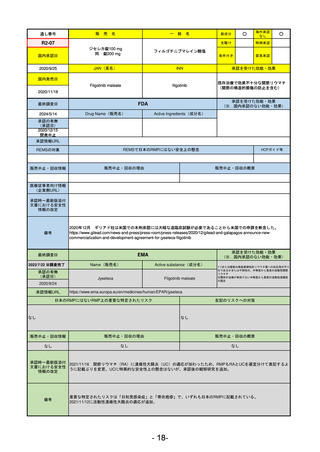
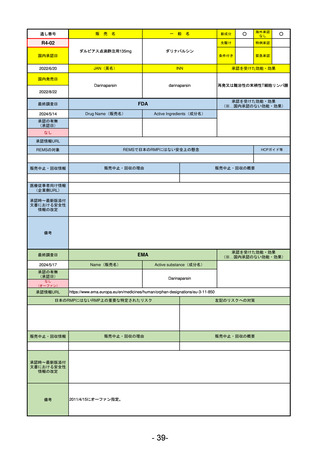
R5-7
ジルビスク皮下注16.6 mgシリンジ 他2規格
ジルコプランナトリウム
全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分
に奏効しない場合に限る)
R5.9.25
2023/10/17
2023/12/1
-
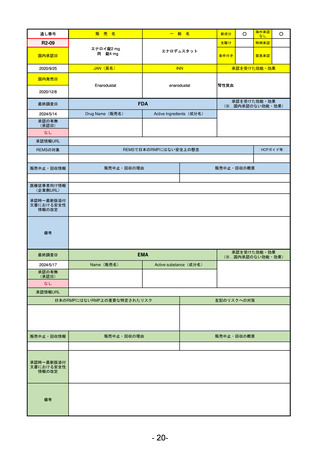
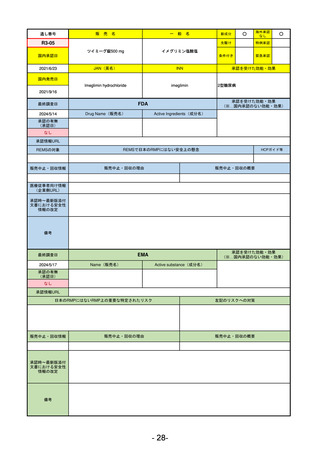
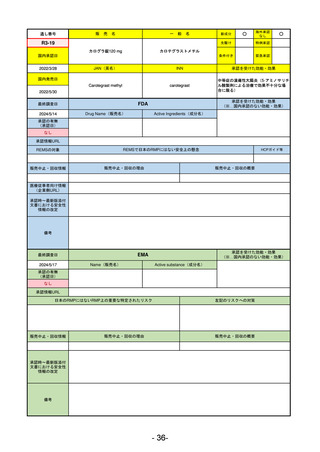
R5-8
エプキンリ皮下注4 mg 他1規格
エプコリタマブ(遺伝子組換え)
再発又は難治性の大細胞型B細胞リンパ腫(びまん性大細胞型B細胞リンパ腫、
高悪性度B細胞リンパ腫及び原発性縦隔大細胞型B細胞リンパ腫)、再発
又は難治性の濾胞性リンパ腫
R5.9.25
2023/5/19
2023/9/22
(条件付承認)
53
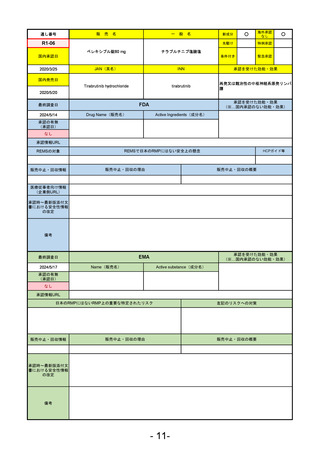
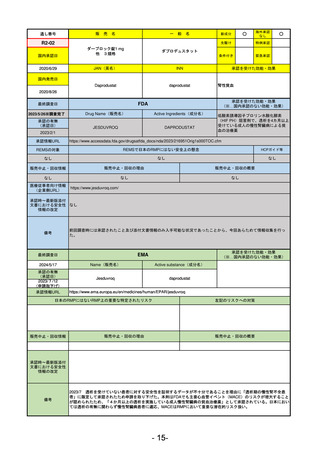
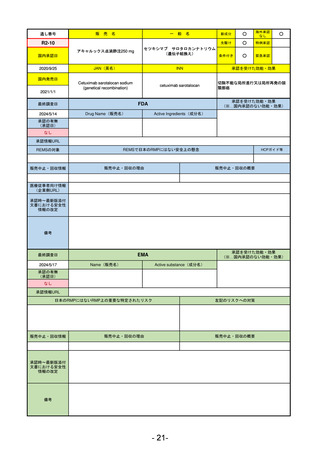
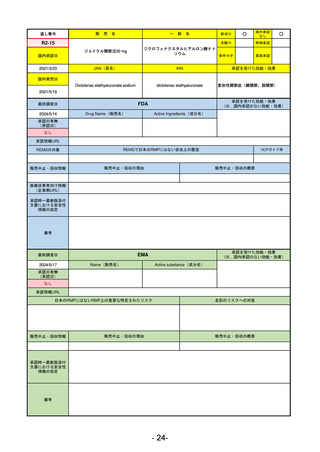
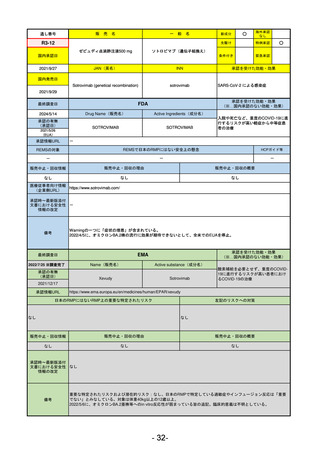
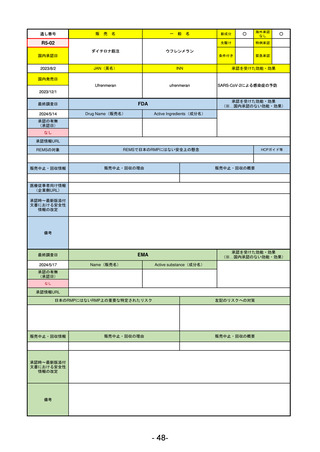
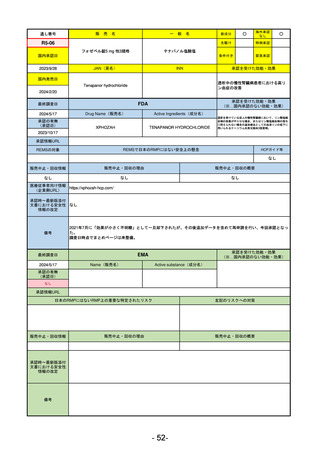
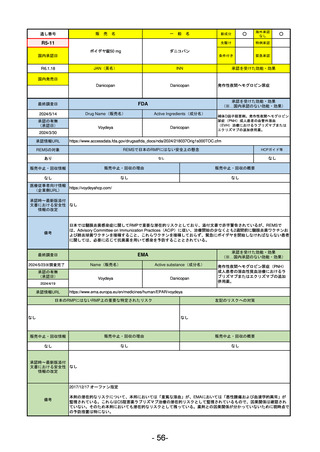
R5-9 コスタイベ筋注用
ザポメラン
SARS-CoV-2による感染症の予防
R5.11.28
なし
なし
54
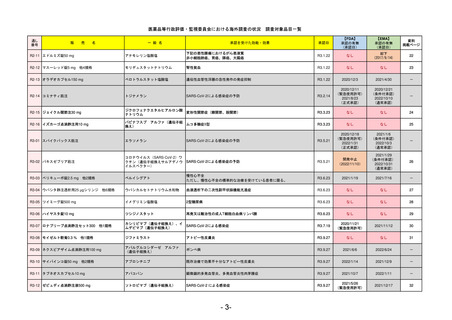
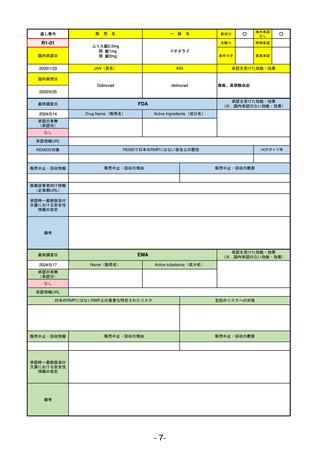
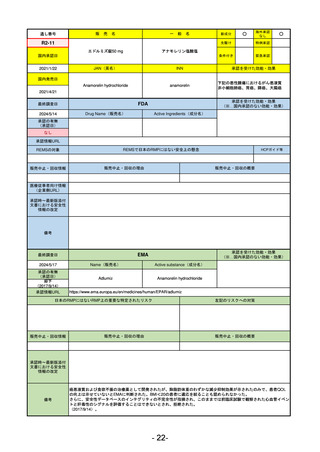
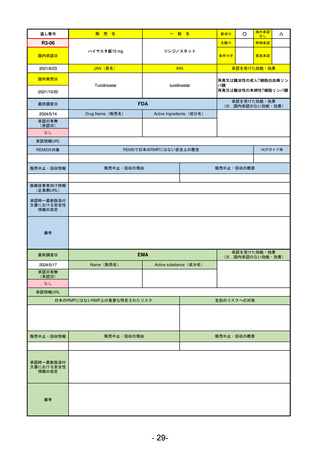
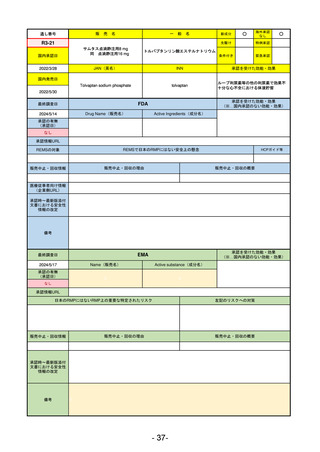
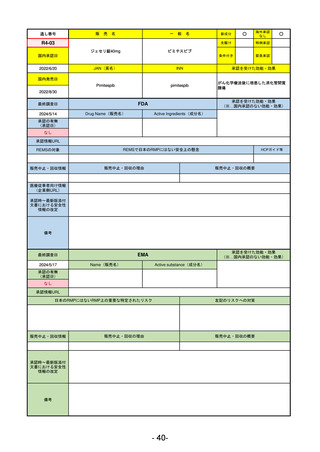
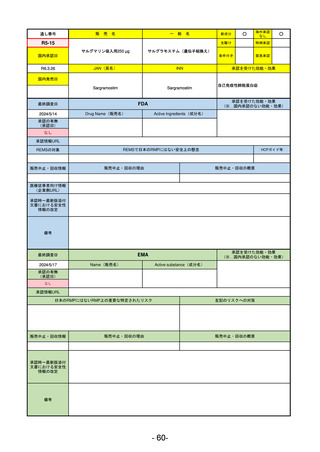
①イブグリース皮下注250 mgシリンジ
R5-10 ②
同
皮下注250 mgオートインジェク
ター
レブリキズマブ(遺伝子組換え)
既存治療で効果不十分なアトピー性皮膚炎
R6.1.18
なし
2023/11/16
55
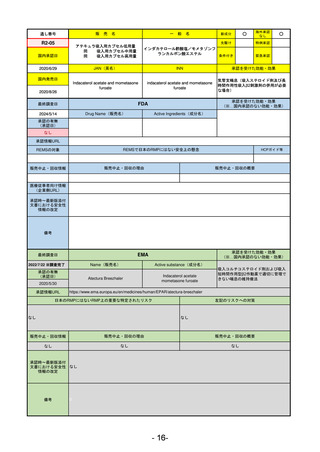
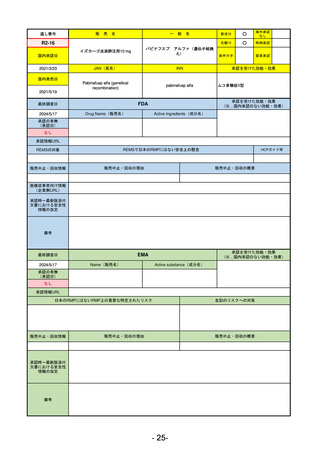
R5-11 ボイデヤ錠50 mg
ダニコパン
発作性夜間ヘモグロビン尿症
R6.1.18
2024/3/30
2024/4/19
56
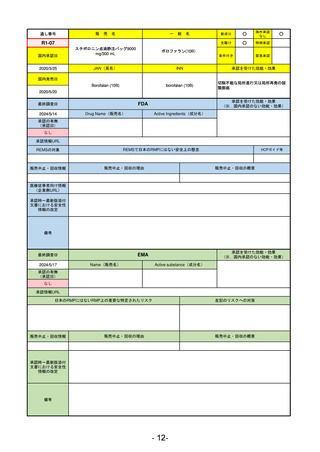
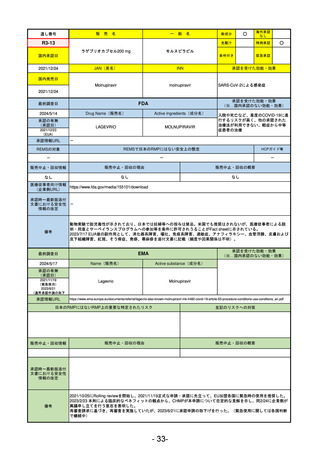
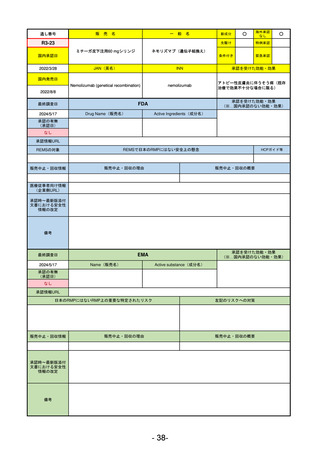
ヒスチジン亜鉛水和物
低亜鉛血症
R6.3.26
なし
なし
57
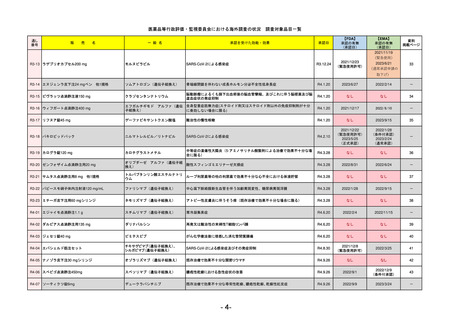
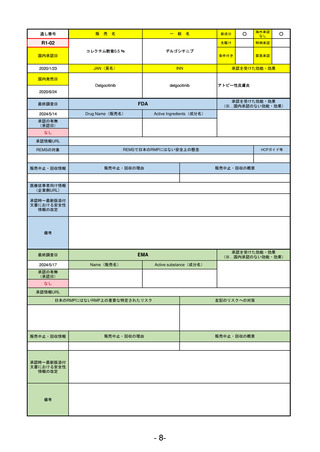
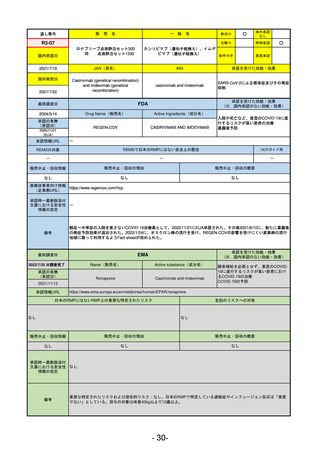
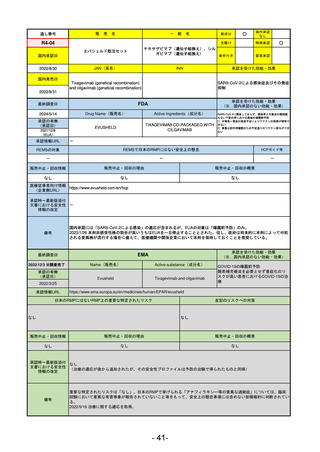
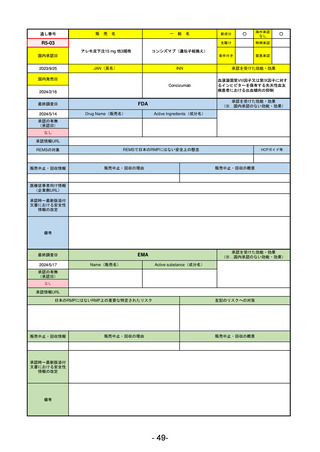
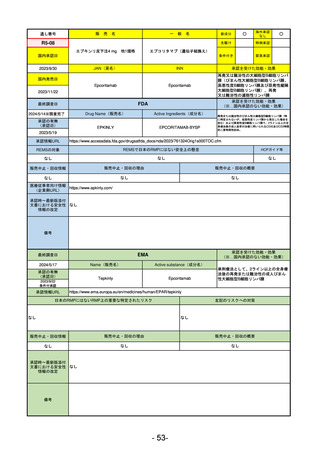
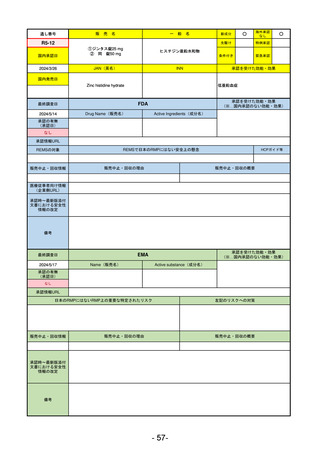
R5-13 ピアスカイ注340 mg
クロバリマブ(遺伝子組換え)
発作性夜間ヘモグロビン尿症
R6.3.26
なし
なし
58
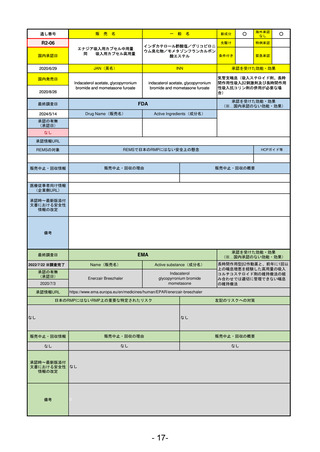
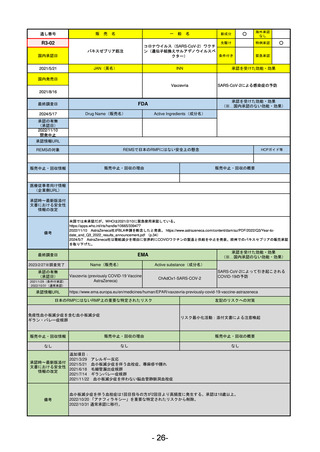
R5-14 アセノベル徐放錠500 mg
アセノイラミン酸
縁取り空胞を伴う遠位型ミオパチーにおける筋力低下の進行抑制
R6.3.26
なし
なし
59
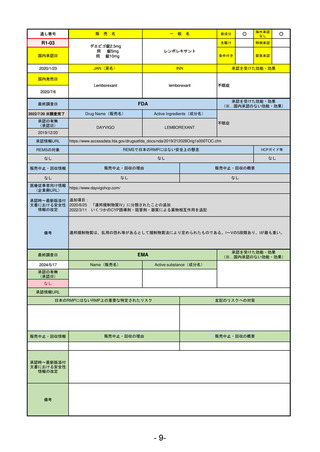
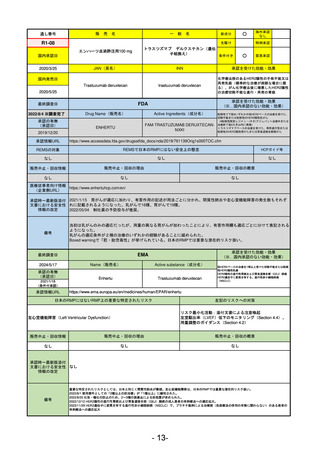
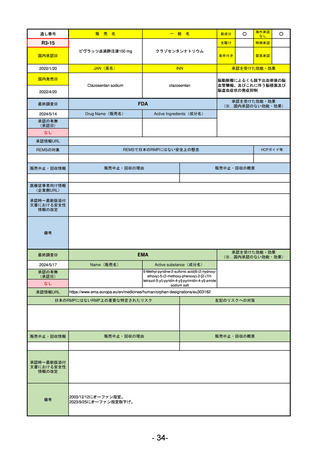
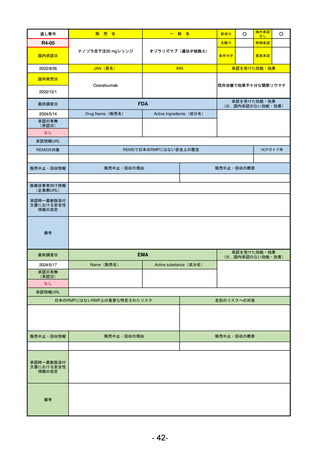
R5-15 サルグマリン吸入用250 µg
サルグラモスチム(遺伝子組換え) 自己免疫性肺胞蛋白症
R6.3.26
なし
なし
60
R5-16 ビロイ点滴静注用100 mg
ゾルベツキシマブ(遺伝子組換え) CLDN18.2陽性の治癒切除不能な進行・再発の胃癌
R6.3.26
なし
なし
61
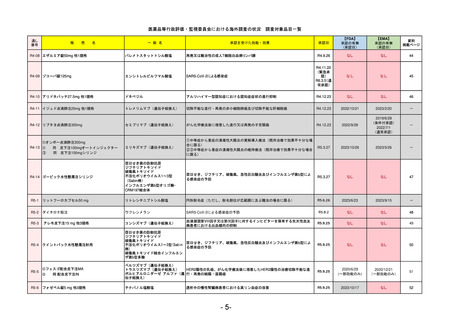
R5-12
①ジンタス錠25 mg
② 同 錠50 mg
※ 「販売名」「一般名」「承認を受けた効能・効果」「承認日」は、原則として調査の対象となった際の情報を記載している。
【個別医薬品の欧米での承認状況等の調査対象品目】
国内で令和2年度以降に販売が開始された新有効成分を含有する新医薬品のうち、以下のa~eのいずれかに該当するもの。
a 先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
b 条件付き早期承認制度の対象品目
c 審査報告書の作成時点において、米国及び欧州で未承認であった品目
d 特例承認を受けた品目
e 緊急承認制度の対象品目
【調査の完了について】
●上記a又はcの調査対象品目
国内の承認審査時に、有効性、安全性等に関して必要なデータの評価を完了しているため、米国及び欧州において正式に承認された場合には、その状況の報告をもって調査目的を達成することから、調査を完了し、以後の対象品目から除外
する。なお、米国又は欧州の一方で承認された場合、当該国又は地域の報告については、その状況の報告をもって調査完了とする。
●上記b、d又はeの調査対象品目
米国及び欧州において正式な承認審査等により、我が国の特例承認等と同様の制度が適用されなくなった(通常承認と同様となった)場合には、その状況の報告をもって調査目的を達成することから、調査を完了し、以後の対象品目から除
外する。なお、米国又は欧州の一方で我が国の特例承認等と同様の制度が適用されなくなった場合、当該国又は地域の報告については、その状況の報告をもって調査完了とする。
【凡例】
…
今回、調査対象として追加した品目
…
正式承認等に伴い、今回の報告をもって米国FDAの承認状況の調査を完了とする品目
…
正式承認等に伴い、今回の報告をもって欧州EMAの承認状況の調査を完了とする品目
…
当該地域における開発の中止、申請の取り下げ、承認の却下等が明らかにされている品目
…
正式承認止等に伴い、前回以前までの報告をもって米国FDA又は欧州EMAの承認状況の調査を完了している品目
(米国FDA、欧州EMAともに調査が完了した後は、販売名、成分名、承認を受けた効能・効果、承認日の項を含めて灰色網掛けをし、以降の調査結果の掲載を割愛しています。)
- 6-
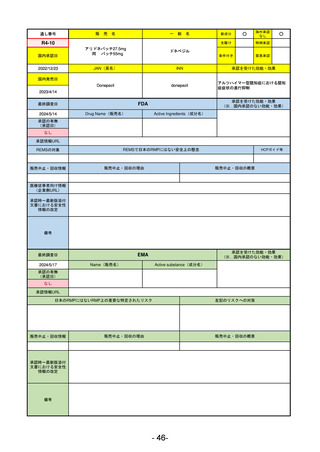
通し
番号
販
売
名
一 般 名
調査対象品目一覧
承認を受けた効能・効果
承認日
【FDA】
承認の有無
(承認日)
【EMA】
承認の有無
(承認日)
資料
掲載ページ
R5-7
ジルビスク皮下注16.6 mgシリンジ 他2規格
ジルコプランナトリウム
全身型重症筋無力症(ステロイド剤又はステロイド剤以外の免疫抑制剤が十分
に奏効しない場合に限る)
R5.9.25
2023/10/17
2023/12/1
-
R5-8
エプキンリ皮下注4 mg 他1規格
エプコリタマブ(遺伝子組換え)
再発又は難治性の大細胞型B細胞リンパ腫(びまん性大細胞型B細胞リンパ腫、
高悪性度B細胞リンパ腫及び原発性縦隔大細胞型B細胞リンパ腫)、再発
又は難治性の濾胞性リンパ腫
R5.9.25
2023/5/19
2023/9/22
(条件付承認)
53
R5-9 コスタイベ筋注用
ザポメラン
SARS-CoV-2による感染症の予防
R5.11.28
なし
なし
54
①イブグリース皮下注250 mgシリンジ
R5-10 ②
同
皮下注250 mgオートインジェク
ター
レブリキズマブ(遺伝子組換え)
既存治療で効果不十分なアトピー性皮膚炎
R6.1.18
なし
2023/11/16
55
R5-11 ボイデヤ錠50 mg
ダニコパン
発作性夜間ヘモグロビン尿症
R6.1.18
2024/3/30
2024/4/19
56
ヒスチジン亜鉛水和物
低亜鉛血症
R6.3.26
なし
なし
57
R5-13 ピアスカイ注340 mg
クロバリマブ(遺伝子組換え)
発作性夜間ヘモグロビン尿症
R6.3.26
なし
なし
58
R5-14 アセノベル徐放錠500 mg
アセノイラミン酸
縁取り空胞を伴う遠位型ミオパチーにおける筋力低下の進行抑制
R6.3.26
なし
なし
59
R5-15 サルグマリン吸入用250 µg
サルグラモスチム(遺伝子組換え) 自己免疫性肺胞蛋白症
R6.3.26
なし
なし
60
R5-16 ビロイ点滴静注用100 mg
ゾルベツキシマブ(遺伝子組換え) CLDN18.2陽性の治癒切除不能な進行・再発の胃癌
R6.3.26
なし
なし
61
R5-12
①ジンタス錠25 mg
② 同 錠50 mg
※ 「販売名」「一般名」「承認を受けた効能・効果」「承認日」は、原則として調査の対象となった際の情報を記載している。
【個別医薬品の欧米での承認状況等の調査対象品目】
国内で令和2年度以降に販売が開始された新有効成分を含有する新医薬品のうち、以下のa~eのいずれかに該当するもの。
a 先駆的医薬品指定制度(先駆け審査指定制度)の対象品目
b 条件付き早期承認制度の対象品目
c 審査報告書の作成時点において、米国及び欧州で未承認であった品目
d 特例承認を受けた品目
e 緊急承認制度の対象品目
【調査の完了について】
●上記a又はcの調査対象品目
国内の承認審査時に、有効性、安全性等に関して必要なデータの評価を完了しているため、米国及び欧州において正式に承認された場合には、その状況の報告をもって調査目的を達成することから、調査を完了し、以後の対象品目から除外
する。なお、米国又は欧州の一方で承認された場合、当該国又は地域の報告については、その状況の報告をもって調査完了とする。
●上記b、d又はeの調査対象品目
米国及び欧州において正式な承認審査等により、我が国の特例承認等と同様の制度が適用されなくなった(通常承認と同様となった)場合には、その状況の報告をもって調査目的を達成することから、調査を完了し、以後の対象品目から除
外する。なお、米国又は欧州の一方で我が国の特例承認等と同様の制度が適用されなくなった場合、当該国又は地域の報告については、その状況の報告をもって調査完了とする。
【凡例】
…
今回、調査対象として追加した品目
…
正式承認等に伴い、今回の報告をもって米国FDAの承認状況の調査を完了とする品目
…
正式承認等に伴い、今回の報告をもって欧州EMAの承認状況の調査を完了とする品目
…
当該地域における開発の中止、申請の取り下げ、承認の却下等が明らかにされている品目
…
正式承認止等に伴い、前回以前までの報告をもって米国FDA又は欧州EMAの承認状況の調査を完了している品目
(米国FDA、欧州EMAともに調査が完了した後は、販売名、成分名、承認を受けた効能・効果、承認日の項を含めて灰色網掛けをし、以降の調査結果の掲載を割愛しています。)
- 6-