よむ、つかう、まなぶ。
【資料5】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[6.2MB] (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41120.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第16回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
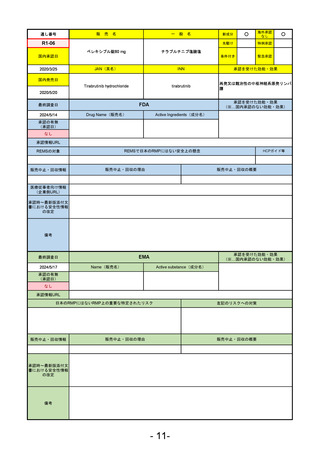
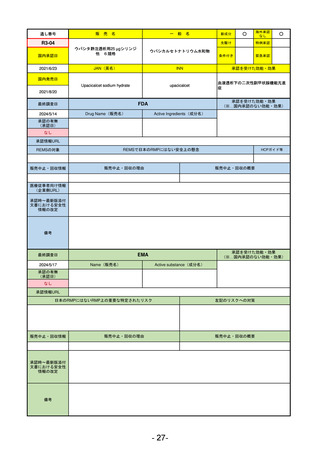
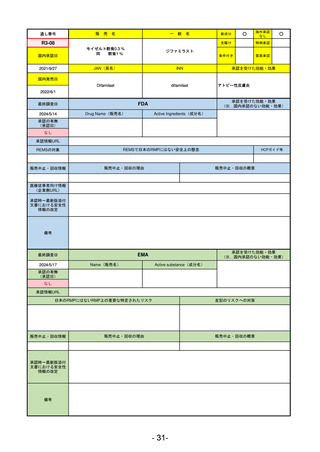
販
通し番号
売
名
一
般
名
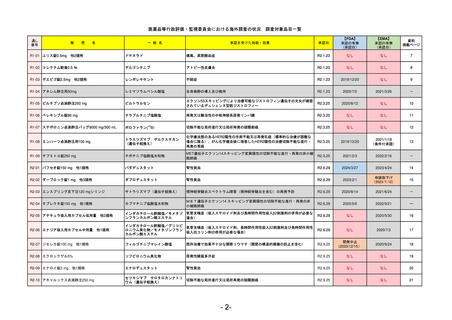
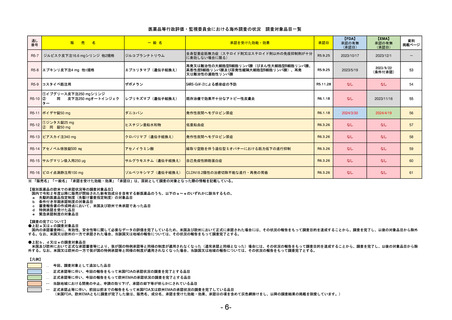
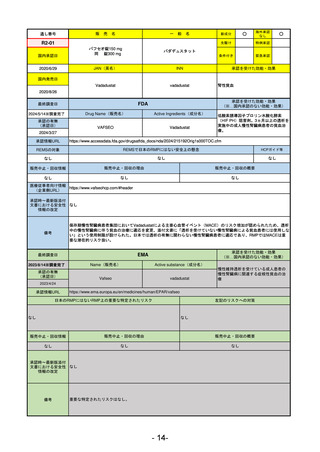
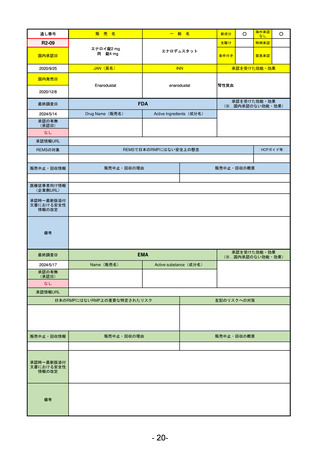
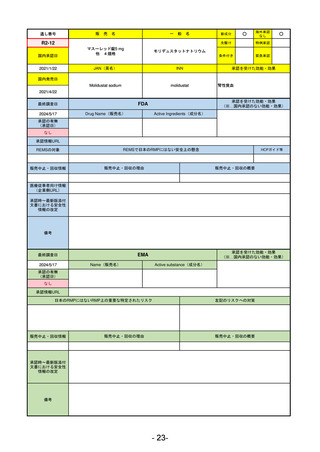
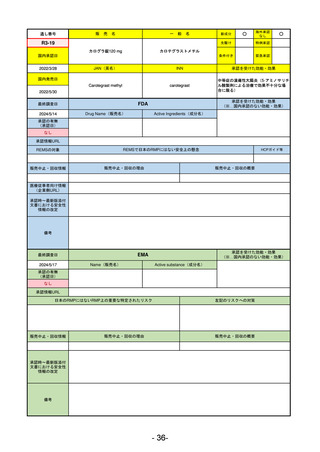
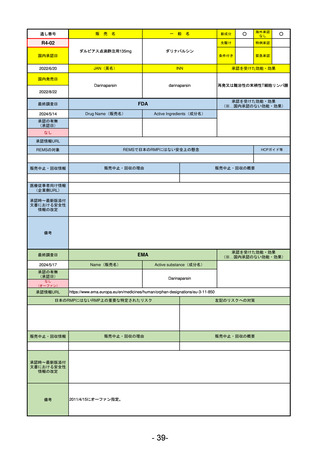
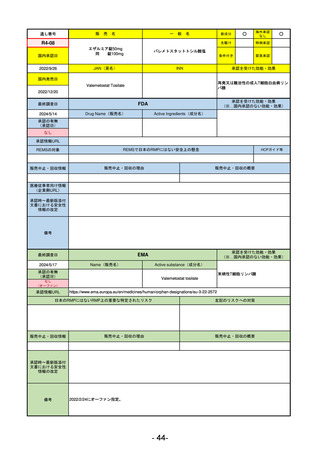
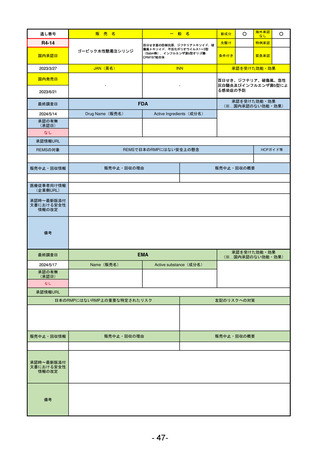
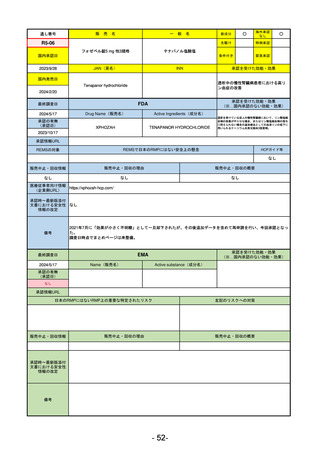
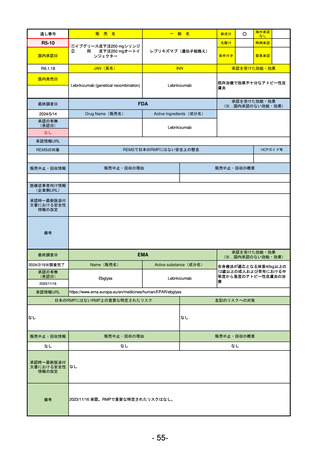
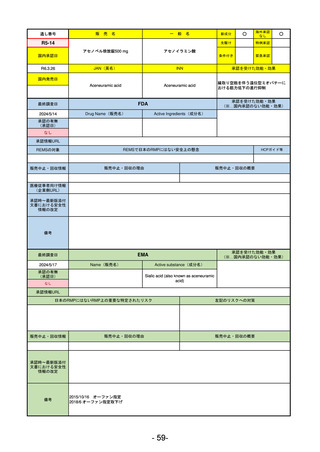
R5-11
ボイデヤ錠50 mg
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
ダニコパン
国内承認日
R6.1.18
新成分
JAN(英名)
INN
Danicopan
Danicopan
承認を受けた効能・効果
国内発売日
発作性夜間ヘモグロビン尿症
1900/1/0
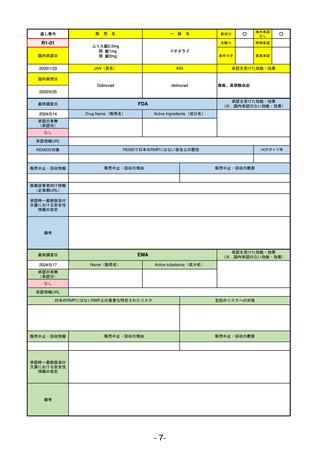
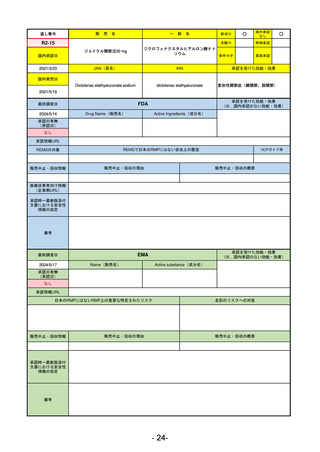
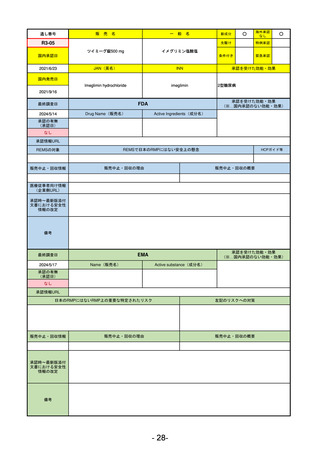
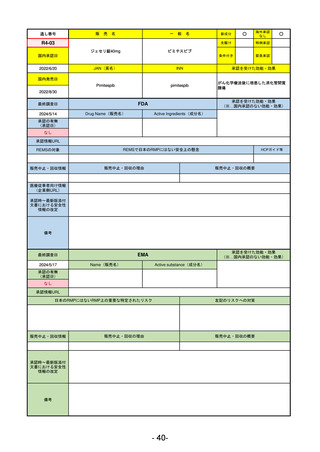
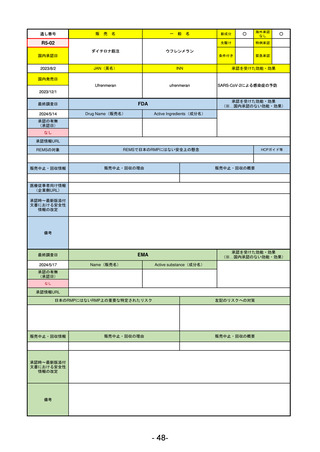
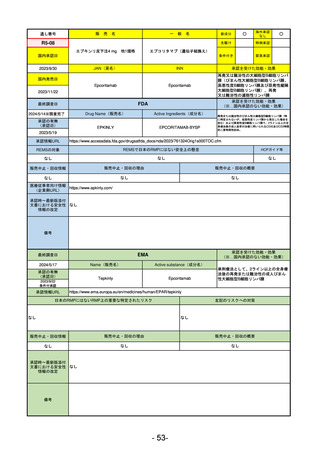
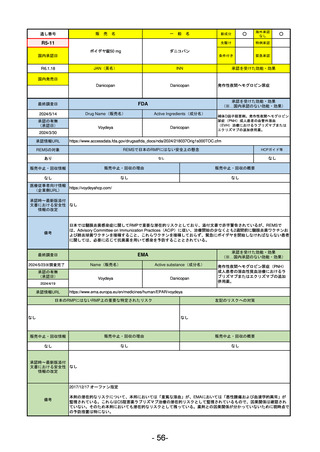
承認を受けた効能・効果
(※…国内承認のない効能・効果)
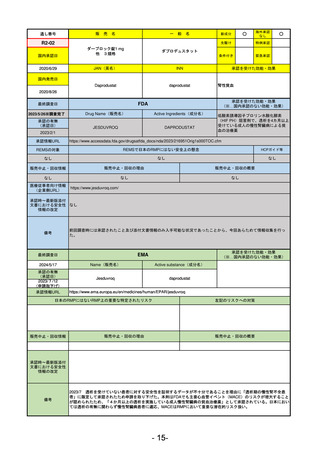
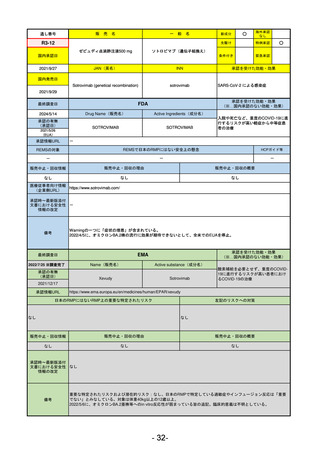
FDA
最終調査日
2024/5/14
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
Voydeya
Danicopan
2024/3/30
承認情報URL
補体D因子阻害剤。発作性夜間ヘモグロビン
尿症(PNH)成人患者の血管外溶血
(EVH)治療におけるラブリズマブまたは
エクリズマブの追加併用薬。
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2024/218037Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
あり
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://voydeyahcp.com/
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
日本では髄膜炎菌感染症に関してRMPで重要な潜在的リスクとしており、添付文書で赤字警告されているが、REMSで
は、Advisory Committee on Immunization Practices(ACIP)に従い、治療開始の少なくとも2週間前に髄膜炎菌ワクチンお
よび肺炎球菌ワクチンを接種すること、これらワクチンを接種しておらず、緊急にボイデヤを開始しなければならない患者
に関しては、必要に応じて抗菌薬を用いて感染を予防することとされている。
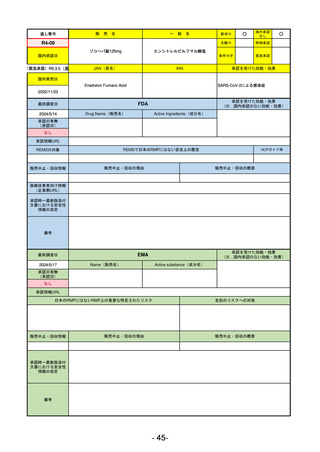
備考
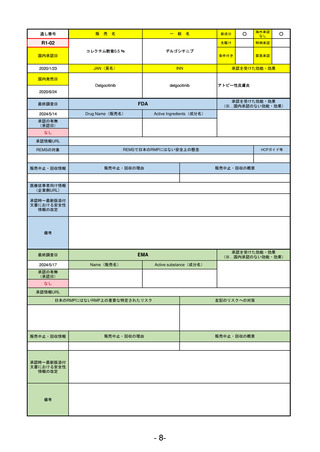
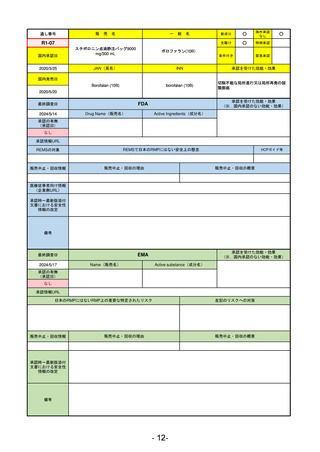
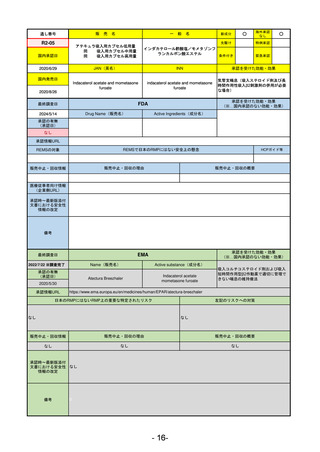
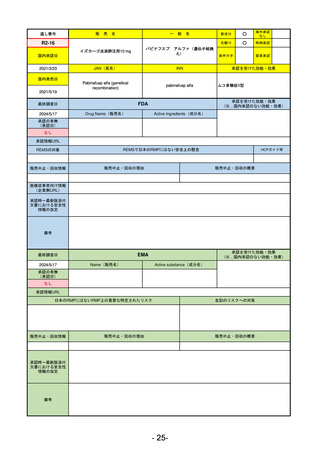
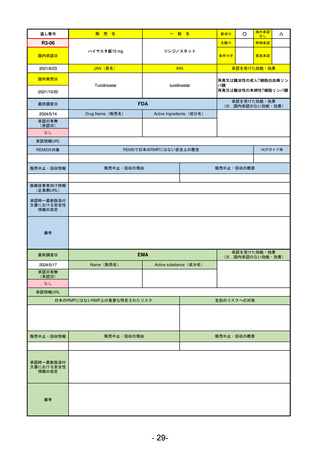
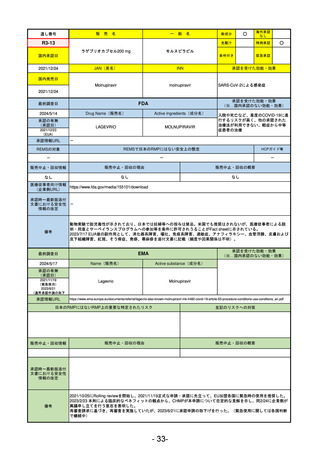
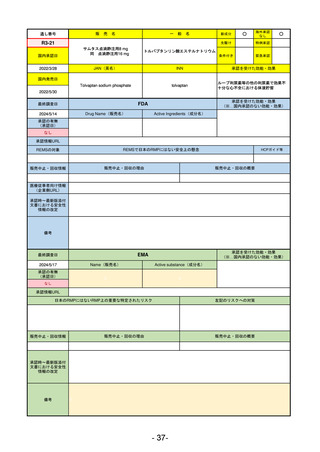
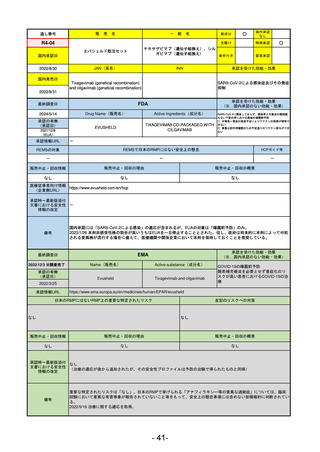
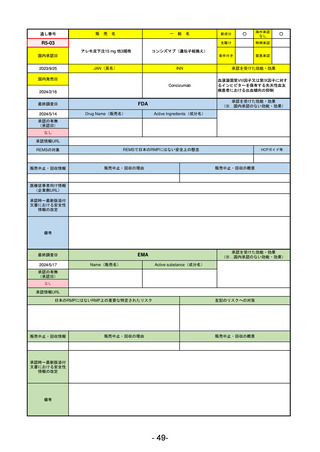
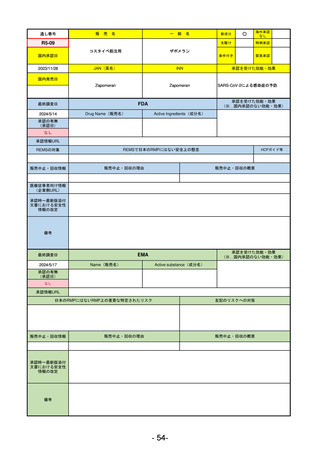
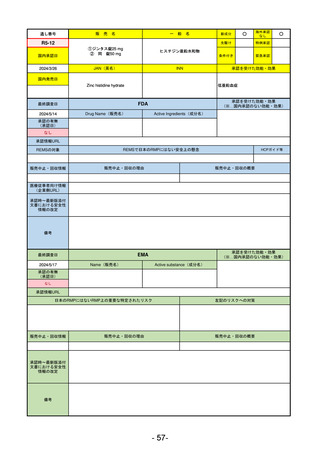
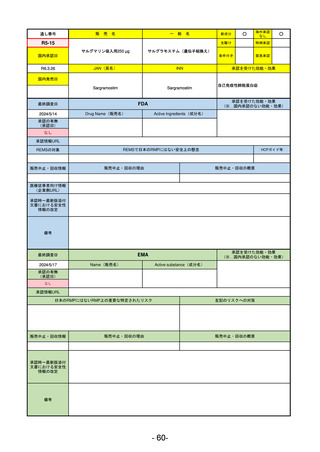
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
2024/5/23※調査完了
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Voydeya
Danicopan
2024/4/19
承認情報URL
発作性夜間ヘモグロビン尿症(PNH)
成人患者の溶血性貧血治療におけるラ
ブリズマブまたはエクリズマブの追加
併用薬。
https://www.ema.europa.eu/en/medicines/human/EPAR/voydeya
日本のRMPにはないRMP上の重要な特定されたリスク
なし
左記のリスクへの対策
なし
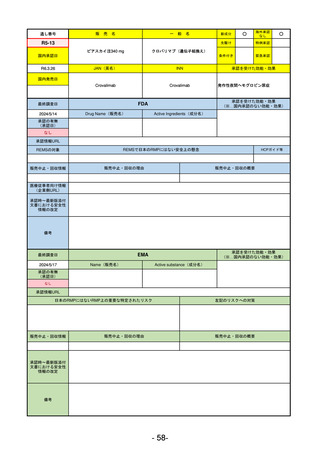
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性 なし
情報の改定
2017/12/17 オーファン指定
備考
本剤の潜在的なリスクについて、本邦においては「重篤な溶血」が、EMAにおいては「悪性腫瘍および血液学的異常」が
監視されている。これらはC5阻害薬ラブリズマブ治療の潜在的リスクとして監視されているもので、因果関係は確認され
ていない。そのため本剤においても潜在的なリスクとして残っている。薬剤との因果関係が分かっていないために現時点で
の予防措置は特にない。
- 56-
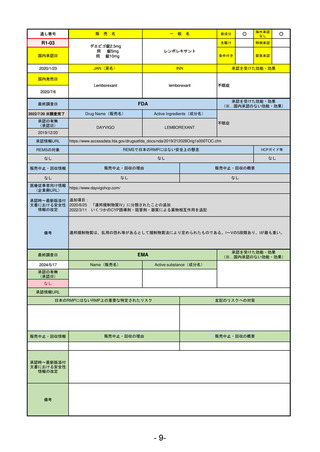
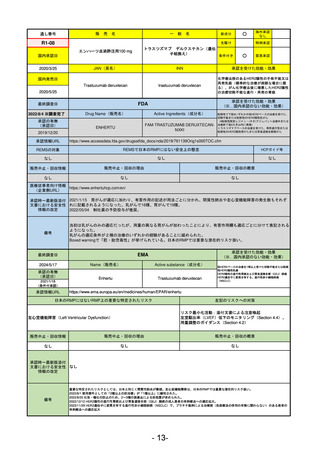
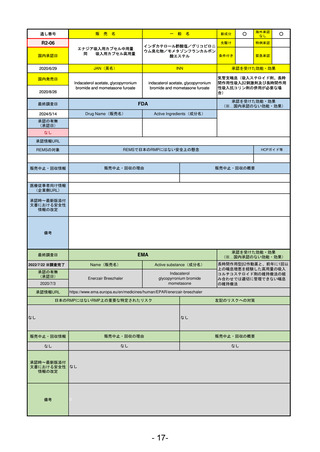
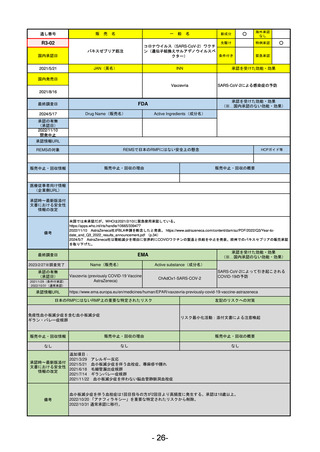
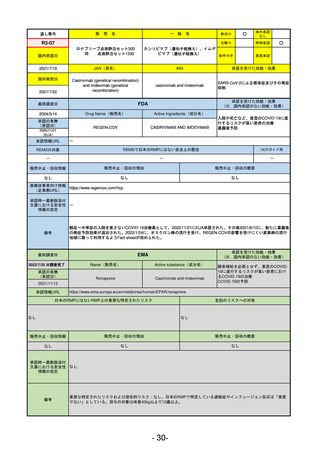
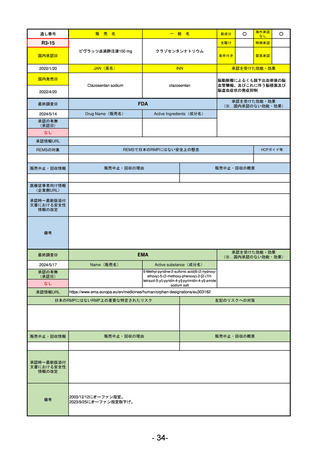
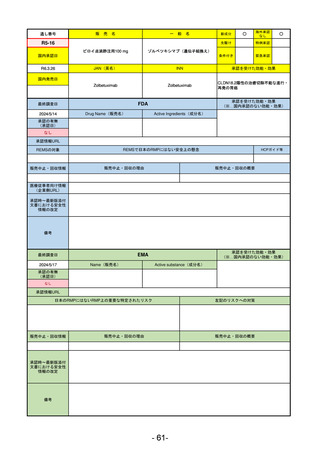
通し番号
売
名
一
般
名
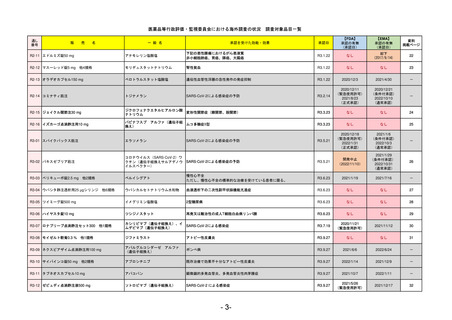
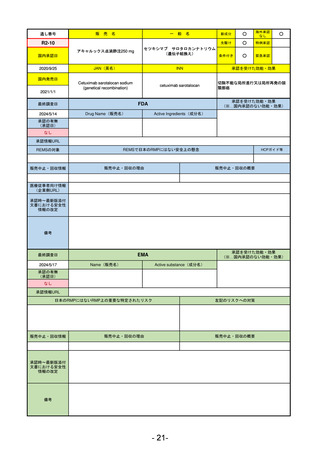
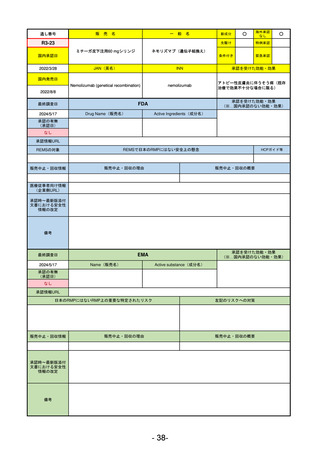
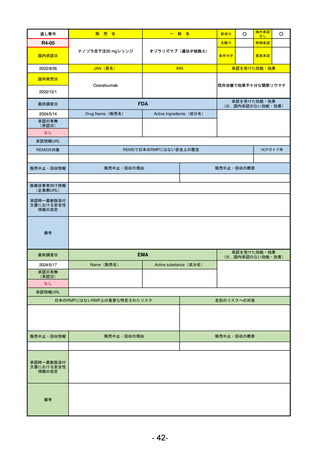
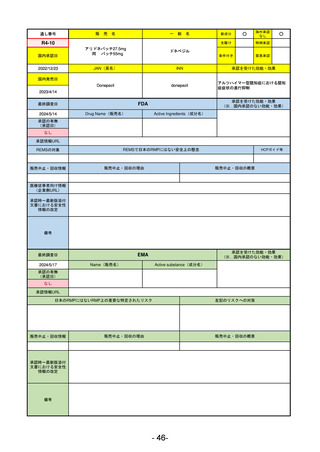
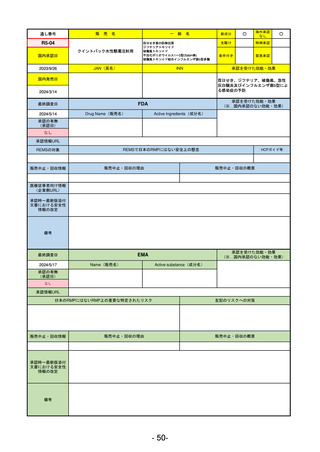
R5-11
ボイデヤ錠50 mg
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
ダニコパン
国内承認日
R6.1.18
新成分
JAN(英名)
INN
Danicopan
Danicopan
承認を受けた効能・効果
国内発売日
発作性夜間ヘモグロビン尿症
1900/1/0
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
2024/5/14
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
Voydeya
Danicopan
2024/3/30
承認情報URL
補体D因子阻害剤。発作性夜間ヘモグロビン
尿症(PNH)成人患者の血管外溶血
(EVH)治療におけるラブリズマブまたは
エクリズマブの追加併用薬。
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2024/218037Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
あり
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://voydeyahcp.com/
(企業側URL)
承認時~最新版添付
文書における安全性 なし
情報の改定
日本では髄膜炎菌感染症に関してRMPで重要な潜在的リスクとしており、添付文書で赤字警告されているが、REMSで
は、Advisory Committee on Immunization Practices(ACIP)に従い、治療開始の少なくとも2週間前に髄膜炎菌ワクチンお
よび肺炎球菌ワクチンを接種すること、これらワクチンを接種しておらず、緊急にボイデヤを開始しなければならない患者
に関しては、必要に応じて抗菌薬を用いて感染を予防することとされている。
備考
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
2024/5/23※調査完了
承認の有無
(承認日)
Name(販売名)
Active substance(成分名)
Voydeya
Danicopan
2024/4/19
承認情報URL
発作性夜間ヘモグロビン尿症(PNH)
成人患者の溶血性貧血治療におけるラ
ブリズマブまたはエクリズマブの追加
併用薬。
https://www.ema.europa.eu/en/medicines/human/EPAR/voydeya
日本のRMPにはないRMP上の重要な特定されたリスク
なし
左記のリスクへの対策
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付
文書における安全性 なし
情報の改定
2017/12/17 オーファン指定
備考
本剤の潜在的なリスクについて、本邦においては「重篤な溶血」が、EMAにおいては「悪性腫瘍および血液学的異常」が
監視されている。これらはC5阻害薬ラブリズマブ治療の潜在的リスクとして監視されているもので、因果関係は確認され
ていない。そのため本剤においても潜在的なリスクとして残っている。薬剤との因果関係が分かっていないために現時点で
の予防措置は特にない。
- 56-