よむ、つかう、まなぶ。
【資料1】テーマ③(国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直し)について.pdf (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41751.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第5回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)デジタルの活用による業務改善等
背景・課題
•
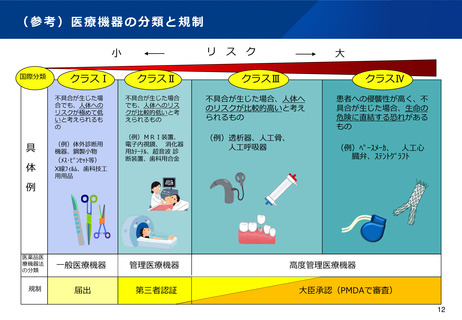
プログラム医療機器(SaMD)については、平成25年の法改正において薬機法上規定されたことを受けて、そ
の後も、SaMDの特性を考慮した効率的な審査が行われる枠組みとしてIDATEN制度の創設や、二段階承認制
度の導入など、SaMDの早期実用化の促進を図ってきたところ。
•
SaMDは、医療機器として診断・治療等に活用されるのみならず、医療の均霑化や医療従事者・患者の負担軽
減などにも貢献しており、単なる医療機器としてではなく、デジタル技術の活用による業務改善等にも繋がる
ツールとして、医療現場において利活用への期待は大きい。
•
SaMD市場は世界的に伸びてきており、国内においてもその市場の拡大が期待されているものの、世界市場と
比較して成長の伸びは緩やかなものであり、経済財政運営と改革の基本方針2024においてもSaMDの更なる実
用化促進が求められている。
検討の方向性(案)
•
SaMDの開発予見性を向上させることを目的として、現在通知に基づき実施している「プログラム医療機器
(SaMD)に係る優先的な審査等の試行的実施」を法制化して先駆的医療機器指定制度の対象を拡充してはどう
か。
•
また、クラスⅡに分類されるSaMDについては、臨床試験や臨床性能評価を要さないなど、一定の要件を満たす
場合には、審査期間の短縮が可能となるよう審査手続きの迅速化を図ってはどうか。
13
背景・課題
•
プログラム医療機器(SaMD)については、平成25年の法改正において薬機法上規定されたことを受けて、そ
の後も、SaMDの特性を考慮した効率的な審査が行われる枠組みとしてIDATEN制度の創設や、二段階承認制
度の導入など、SaMDの早期実用化の促進を図ってきたところ。
•
SaMDは、医療機器として診断・治療等に活用されるのみならず、医療の均霑化や医療従事者・患者の負担軽
減などにも貢献しており、単なる医療機器としてではなく、デジタル技術の活用による業務改善等にも繋がる
ツールとして、医療現場において利活用への期待は大きい。
•
SaMD市場は世界的に伸びてきており、国内においてもその市場の拡大が期待されているものの、世界市場と
比較して成長の伸びは緩やかなものであり、経済財政運営と改革の基本方針2024においてもSaMDの更なる実
用化促進が求められている。
検討の方向性(案)
•
SaMDの開発予見性を向上させることを目的として、現在通知に基づき実施している「プログラム医療機器
(SaMD)に係る優先的な審査等の試行的実施」を法制化して先駆的医療機器指定制度の対象を拡充してはどう
か。
•
また、クラスⅡに分類されるSaMDについては、臨床試験や臨床性能評価を要さないなど、一定の要件を満たす
場合には、審査期間の短縮が可能となるよう審査手続きの迅速化を図ってはどうか。
13