よむ、つかう、まなぶ。
【資料1】テーマ③(国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直し)について.pdf (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41751.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第5回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
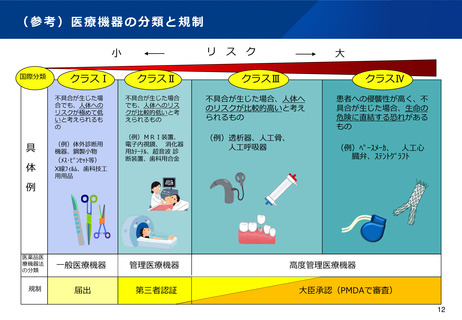
(1)体外診断用医薬品の特性を踏まえた制度の見直し
①市販後の継続的な性能確保や不具合報告制度の構築など
背景・課題
•
新型コロナウイルス感染症の感染拡大により、検査キットの需要・供給が急速に増大していることから、体外診断用医薬品に対
する国民からの信頼性確保に向けた取組みが求められている。
•
ウイルス等を検出する体外診断用医薬品については、ウイルス等が宿主の免疫システムや薬剤による排除等を回避するために絶
えず変異していることから、承認時に性能が担保されていてもその後の変異によって性能が左右される特性があり、市販後もそ
の性能を担保し続けるためには、ウイルス等の変異に応じた対応が必要である。
•
また、体外診断用医薬品は人の身体に直接使用されないことから研究開発において臨床試験が実施されることはないものの、臨
床検体を用いた性能試験が実施されることがある。しかしながら、性能試験の基準等が存在しないことから、データの信頼性等
が十分であるとは言い難い状況である。
•
体外診断用医薬品は医薬品として副作用報告が求められているが、人の身体に直接使用されないことから、副作用の概念が当て
はめにくい。また、諸外国では、体外診断用医薬品の報告が医療機器の不具合報告に包含されているところ、国内の取扱いは国
際的な取扱いと整合していない。
•
他方で、公衆衛生上特に重要と考えられる体外診断用医薬品については、品目仕様として規定している性能を実地で確認するこ
とで品目仕様の適否の評価を目的とした製造販売承認前試験を昭和60年頃より実施しているが、現在はPMDAによる審査が行わ
れ、QMSによって製造管理や品質管理が担保されていることから、製造販売承認前試験の意義が薄れている状況である。
検討の方向性(案)
•
新型コロナウイルスのように特に変異の多いウイルス等を検出する体外診断用医薬品については、市販後の性
能担保に必要となる措置が可能となるよう、制度を見直してはどうか。
•
臨床検体を用いた性能試験におけるデータについて更なる信頼性を確保するため、基準を定めることとしては
どうか。
•
国際整合の観点から、現状の副作用報告制度から、医療機器と同様の不具合報告制度へ移行することとしては
どうか。
•
製造販売承認前試験について、現在は個別に審査が行われ、製造管理や品質管理が担保されていることから、
3
不要としてはどうか。
①市販後の継続的な性能確保や不具合報告制度の構築など
背景・課題
•
新型コロナウイルス感染症の感染拡大により、検査キットの需要・供給が急速に増大していることから、体外診断用医薬品に対
する国民からの信頼性確保に向けた取組みが求められている。
•
ウイルス等を検出する体外診断用医薬品については、ウイルス等が宿主の免疫システムや薬剤による排除等を回避するために絶
えず変異していることから、承認時に性能が担保されていてもその後の変異によって性能が左右される特性があり、市販後もそ
の性能を担保し続けるためには、ウイルス等の変異に応じた対応が必要である。
•
また、体外診断用医薬品は人の身体に直接使用されないことから研究開発において臨床試験が実施されることはないものの、臨
床検体を用いた性能試験が実施されることがある。しかしながら、性能試験の基準等が存在しないことから、データの信頼性等
が十分であるとは言い難い状況である。
•
体外診断用医薬品は医薬品として副作用報告が求められているが、人の身体に直接使用されないことから、副作用の概念が当て
はめにくい。また、諸外国では、体外診断用医薬品の報告が医療機器の不具合報告に包含されているところ、国内の取扱いは国
際的な取扱いと整合していない。
•
他方で、公衆衛生上特に重要と考えられる体外診断用医薬品については、品目仕様として規定している性能を実地で確認するこ
とで品目仕様の適否の評価を目的とした製造販売承認前試験を昭和60年頃より実施しているが、現在はPMDAによる審査が行わ
れ、QMSによって製造管理や品質管理が担保されていることから、製造販売承認前試験の意義が薄れている状況である。
検討の方向性(案)
•
新型コロナウイルスのように特に変異の多いウイルス等を検出する体外診断用医薬品については、市販後の性
能担保に必要となる措置が可能となるよう、制度を見直してはどうか。
•
臨床検体を用いた性能試験におけるデータについて更なる信頼性を確保するため、基準を定めることとしては
どうか。
•
国際整合の観点から、現状の副作用報告制度から、医療機器と同様の不具合報告制度へ移行することとしては
どうか。
•
製造販売承認前試験について、現在は個別に審査が行われ、製造管理や品質管理が担保されていることから、
3
不要としてはどうか。