よむ、つかう、まなぶ。
【資料1】テーマ③(国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直し)について.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41751.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第5回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
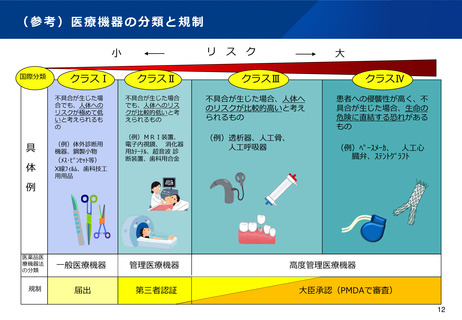
(参考)製造販売承認前試験
目的
製造販売承認前試験は、公衆衛生上特に重要な体外診断用医薬品(例えば、梅毒、HBV等感染症の診断に使用されるもの)について、
国立感染症研究所(以下「感染研」)が、体外診断用医薬品製造販売承認申請書又は外国製造体外診断用医薬品製造販売承認申請書(以
下「承認申請書」)に品目仕様として規定している性能を実地で確認することで、品目仕様の適否を評価することを目的とする。
手続きとタイムスケジュール
• PMDAは、申請者から提出された承認申請書等の内容を踏まえ、承認前試験対象品目かどうかの確認を行う。
• PMDAは、感染研に情報共有するとともに、厚労省へ連絡する。(厚労省は、感染研に承認前試験の実施を
1ヶ月
PMDA
(事前確認)
依頼する。)
• 感染研は、承認申請書等の内容を踏まえ、承認前試験の実施に際して疑問点等があれば、PMDAを通じて申
請者に対して照会する。
3ヶ月
感染研
(委員会審議)
• 感染研は、体外診断薬委員会で承認前試験の実施を決定したときは、申請者に対して通知する。(その際、
試験実施の場所や日時等を調整する。)
• 感染研は、申請者から提供された試験品(原則3ロット)で承認前試験を実施する。
(試験内容)感染研が作成したパネル(陽性検体、陰性検体)等を用いた
正確性試験、同時再現性試験、ロット間差試験、既存承認品との相関性試験
2ヶ月
・・・etc
感染研
•感染研は、承認前試験の結果を厚労省に報告する。(厚労省は、PMDAに送付する。)
(承認前試験)
4
目的
製造販売承認前試験は、公衆衛生上特に重要な体外診断用医薬品(例えば、梅毒、HBV等感染症の診断に使用されるもの)について、
国立感染症研究所(以下「感染研」)が、体外診断用医薬品製造販売承認申請書又は外国製造体外診断用医薬品製造販売承認申請書(以
下「承認申請書」)に品目仕様として規定している性能を実地で確認することで、品目仕様の適否を評価することを目的とする。
手続きとタイムスケジュール
• PMDAは、申請者から提出された承認申請書等の内容を踏まえ、承認前試験対象品目かどうかの確認を行う。
• PMDAは、感染研に情報共有するとともに、厚労省へ連絡する。(厚労省は、感染研に承認前試験の実施を
1ヶ月
PMDA
(事前確認)
依頼する。)
• 感染研は、承認申請書等の内容を踏まえ、承認前試験の実施に際して疑問点等があれば、PMDAを通じて申
請者に対して照会する。
3ヶ月
感染研
(委員会審議)
• 感染研は、体外診断薬委員会で承認前試験の実施を決定したときは、申請者に対して通知する。(その際、
試験実施の場所や日時等を調整する。)
• 感染研は、申請者から提供された試験品(原則3ロット)で承認前試験を実施する。
(試験内容)感染研が作成したパネル(陽性検体、陰性検体)等を用いた
正確性試験、同時再現性試験、ロット間差試験、既存承認品との相関性試験
2ヶ月
・・・etc
感染研
•感染研は、承認前試験の結果を厚労省に報告する。(厚労省は、PMDAに送付する。)
(承認前試験)
4