よむ、つかう、まなぶ。
【資料1】テーマ③(国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直し)について.pdf (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41751.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第5回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
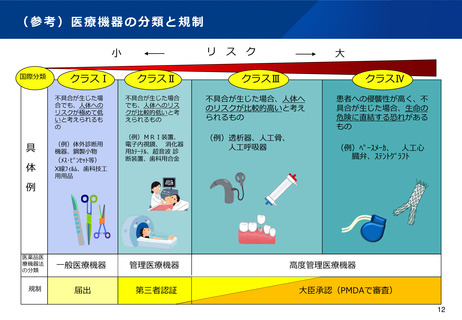
(参考)医薬品の範囲の明確化に対する取組(いわゆる46通知)①
無承認無許可医薬品の指導取締りについて(昭和46年6月1日 薬発第476号厚生省薬務局長通知)
別紙 医薬品の範囲に関する基準(抄)
人が経口的に服用する物が、医薬品、医療機器等の品質、有効性及び安全性の確
保等に関する法律(昭和35年法律第145号)第2条第1項第2号又は第3号に規定
する医薬品に該当するか否かは、医薬品としての目的を有しているか、又は通常人
が医薬品としての目的を有するものであると認識するかどうかにより判断すること
となる。通常人が同項第2号又は第3号に掲げる目的を有するものであると認識す
るかどうかは、その物の成分本質(原材料)、形状(剤型、容器、包装、意匠等を
いう。)及びその物に表示された使用目的・効能効果・用法用量並びに販売方法、
販売の際の演述等を総合的に判断すべきものである。
したがって、医薬品に該当するか否かは、個々の製品について、上記の要素を総
合的に検討のうえ判定すべきものであり、その判定の方法は、Ⅰの「医薬品の判定
における各要素の解釈」に基づいて、その物の成分本質(原材料)を分類し、効能
効果、形状及び用法用量が医薬品的であるかどうかを検討のうえ、Ⅱの「判定方
法」により行うものとする。
7
無承認無許可医薬品の指導取締りについて(昭和46年6月1日 薬発第476号厚生省薬務局長通知)
別紙 医薬品の範囲に関する基準(抄)
人が経口的に服用する物が、医薬品、医療機器等の品質、有効性及び安全性の確
保等に関する法律(昭和35年法律第145号)第2条第1項第2号又は第3号に規定
する医薬品に該当するか否かは、医薬品としての目的を有しているか、又は通常人
が医薬品としての目的を有するものであると認識するかどうかにより判断すること
となる。通常人が同項第2号又は第3号に掲げる目的を有するものであると認識す
るかどうかは、その物の成分本質(原材料)、形状(剤型、容器、包装、意匠等を
いう。)及びその物に表示された使用目的・効能効果・用法用量並びに販売方法、
販売の際の演述等を総合的に判断すべきものである。
したがって、医薬品に該当するか否かは、個々の製品について、上記の要素を総
合的に検討のうえ判定すべきものであり、その判定の方法は、Ⅰの「医薬品の判定
における各要素の解釈」に基づいて、その物の成分本質(原材料)を分類し、効能
効果、形状及び用法用量が医薬品的であるかどうかを検討のうえ、Ⅱの「判定方
法」により行うものとする。
7