よむ、つかう、まなぶ。
【資料1】テーマ③(国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直し)について.pdf (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_41751.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第5回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
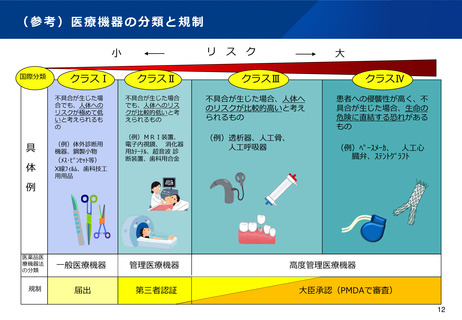
テーマ③:国民からの信頼性確保に向けた体外診断用医薬品・医療機器の規制の見直
し
背景・課題
•
新型コロナウイルス感染症の感染拡大により、検査キットの需要・供給が急速に増大する中、市販後にそ
の性能を担保し続けるためには、ウイルス等の変異に応じた対応が必要である等の課題が判明している。
このため、体外診断用医薬品の特性を踏まえた適切な規制のあり方を検討する必要がある。
•
医療機器の登録認証機関による登録認証業務からの撤退事例の発生を受け、事業撤退等に備えたルールの
整備等、登録認証制度の改善を行う必要がある。
ご議論いただきたい事項
(1)市販後の継続的な性能確保や不具合報告制度の構築など、体外診断用医薬品の特性を踏まえた制度の見
直し
(2)医療機器の登録認証業務の撤退時のルールの整備など、登録認証制度の安定的な運用に向けた制度の見
直し
(3)デジタルの活用による業務改善等
(4)製造管理者要件等の見直し
※ 第1回医薬品医療機器制度部会 資料2-1を一部改変 2
し
背景・課題
•
新型コロナウイルス感染症の感染拡大により、検査キットの需要・供給が急速に増大する中、市販後にそ
の性能を担保し続けるためには、ウイルス等の変異に応じた対応が必要である等の課題が判明している。
このため、体外診断用医薬品の特性を踏まえた適切な規制のあり方を検討する必要がある。
•
医療機器の登録認証機関による登録認証業務からの撤退事例の発生を受け、事業撤退等に備えたルールの
整備等、登録認証制度の改善を行う必要がある。
ご議論いただきたい事項
(1)市販後の継続的な性能確保や不具合報告制度の構築など、体外診断用医薬品の特性を踏まえた制度の見
直し
(2)医療機器の登録認証業務の撤退時のルールの整備など、登録認証制度の安定的な運用に向けた制度の見
直し
(3)デジタルの活用による業務改善等
(4)製造管理者要件等の見直し
※ 第1回医薬品医療機器制度部会 資料2-1を一部改変 2