よむ、つかう、まなぶ。
薬費-1高額医薬品(認知症薬)に対する対応 (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44127.html |
| 出典情報 | 薬価専門部会・費用対効果評価専門部会合同部会(第6回 10/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考)ケサンラの添付文書の記載
中医協 総-1
6 . 9 . 2 5
一 部 改 変
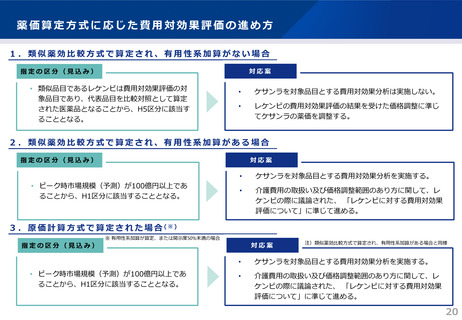
本剤の投与対象患者や医師、施設の要件に関して、添付文書の規定も踏まえ、最適使用推進ガイドラインにお
いて具体的な要件を定めることとしている。
1. 警告
1.1 本剤の投与は、アミロイド PET、MRI 等の本剤投与にあたり必要な検査及び管理が実施可能な医療施設又は当該医療施設と連携可能な
医療施設において、アルツハイマー病の病態、診断、治療に関する十分な知識及び経験を有し、本剤のリスク等について十分に管理・
説明できる医師の下で、本剤の投与が適切と判断される患者のみに行うこと。
1.2 本剤の投与開始に先立ち、本剤投与による ARIA の発現割合、ARIA のリスク及びリスク管理のために必要な検査、ARIA発現時の対処
法について、患者及び家族・介護者に十分な情報を提供して説明し、同意を得てから投与すること。また、異常が認められた場合には、
速やかに主治医に連絡するよう指導すること。
5. 効能又は効果に関連する注意
5.2 承認を受けた診断方法、例えばアミロイド PET、脳脊髄液(CSF)検査、又は同等の診断法によりアミロイドβ病理を示唆する所見が確
認され、アルツハイマー病と診断された患者のみに本剤を使用すること。
5.3 無症候でアミロイドβ病理を示唆する所見のみが確認できた者、及び中等度以降のアルツハイマー病による認知症患者に本剤を投与開
始しないこと。
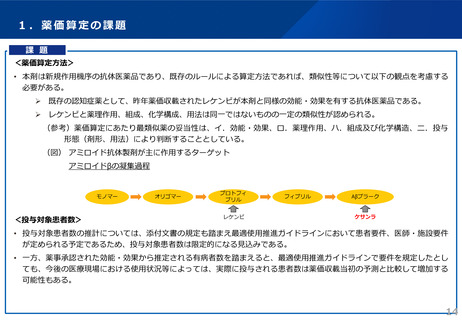
5.4 「17. 臨床成績」の項の内容を熟知し、国際共同第 III 相試験で用いられた診断基準、組み入れられた患者の臨床症状スコアの範囲、試
験結果等を十分に理解した上で本剤投与の適否を判断すること。
7. 用法及び用量に関連する注意
7.1 安全性上の理由等で本剤 1400mg に増量できない場合は、漫然と投与を継続しないこと。
7.2 本剤投与中にアミロイドβプラークの除去が確認された場合は、その時点で本剤の投与を完了すること。アミロイドβプラークの除去が
確認されない場合であっても、本剤の投与は原則として最長18ヵ月で完了すること。18ヵ月を超えて投与する場合は、18ヵ月時点まで
の副作用の発現状況、臨床症状の推移やアミロイドβプラークの変化等を考慮し、慎重に判断すること。
7.3 アミロイドβプラークの除去は、アミロイドPET検査又は同等の診断法により評価し、検査を実施する場合の時期は本剤投与開始後
12ヵ月を目安とすること。
7.4 本剤投与中は 6 ヵ月毎を目安に認知機能検査、患者及び家族・介護者から自他覚症状の聴取等による臨床症状の評価を行い、臨床症状
の経過、認知症の重症度等から本剤の有効性が期待できないと考えられる場合は本剤の投与を中止すること。なお、本剤投与中に認知
症の重症度が中等度以降に進行した患者に投与を継続したときの有効性は確立していない。
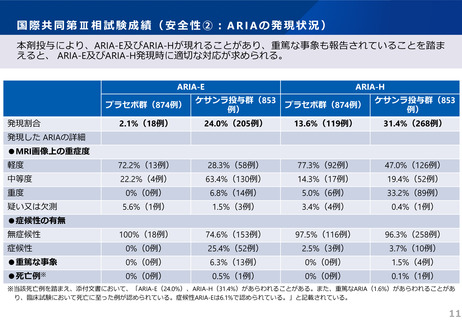
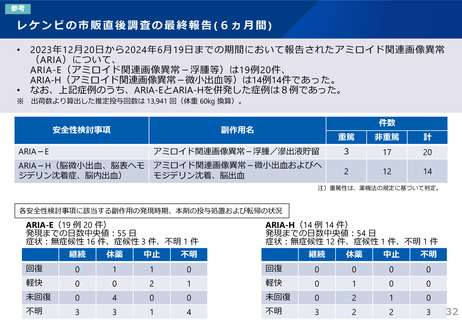
7.5 本剤投与により、アミロイド関連画像異常(ARIA)としてARIA-浮腫/滲出液貯留(ARIA-E)もしくはARIA-脳微小出血・脳表ヘモジデ
リン沈着症(ARIA-H)、又は脳出血があらわれることがある。
27
中医協 総-1
6 . 9 . 2 5
一 部 改 変
本剤の投与対象患者や医師、施設の要件に関して、添付文書の規定も踏まえ、最適使用推進ガイドラインにお
いて具体的な要件を定めることとしている。
1. 警告
1.1 本剤の投与は、アミロイド PET、MRI 等の本剤投与にあたり必要な検査及び管理が実施可能な医療施設又は当該医療施設と連携可能な
医療施設において、アルツハイマー病の病態、診断、治療に関する十分な知識及び経験を有し、本剤のリスク等について十分に管理・
説明できる医師の下で、本剤の投与が適切と判断される患者のみに行うこと。
1.2 本剤の投与開始に先立ち、本剤投与による ARIA の発現割合、ARIA のリスク及びリスク管理のために必要な検査、ARIA発現時の対処
法について、患者及び家族・介護者に十分な情報を提供して説明し、同意を得てから投与すること。また、異常が認められた場合には、
速やかに主治医に連絡するよう指導すること。
5. 効能又は効果に関連する注意
5.2 承認を受けた診断方法、例えばアミロイド PET、脳脊髄液(CSF)検査、又は同等の診断法によりアミロイドβ病理を示唆する所見が確
認され、アルツハイマー病と診断された患者のみに本剤を使用すること。
5.3 無症候でアミロイドβ病理を示唆する所見のみが確認できた者、及び中等度以降のアルツハイマー病による認知症患者に本剤を投与開
始しないこと。
5.4 「17. 臨床成績」の項の内容を熟知し、国際共同第 III 相試験で用いられた診断基準、組み入れられた患者の臨床症状スコアの範囲、試
験結果等を十分に理解した上で本剤投与の適否を判断すること。
7. 用法及び用量に関連する注意
7.1 安全性上の理由等で本剤 1400mg に増量できない場合は、漫然と投与を継続しないこと。
7.2 本剤投与中にアミロイドβプラークの除去が確認された場合は、その時点で本剤の投与を完了すること。アミロイドβプラークの除去が
確認されない場合であっても、本剤の投与は原則として最長18ヵ月で完了すること。18ヵ月を超えて投与する場合は、18ヵ月時点まで
の副作用の発現状況、臨床症状の推移やアミロイドβプラークの変化等を考慮し、慎重に判断すること。
7.3 アミロイドβプラークの除去は、アミロイドPET検査又は同等の診断法により評価し、検査を実施する場合の時期は本剤投与開始後
12ヵ月を目安とすること。
7.4 本剤投与中は 6 ヵ月毎を目安に認知機能検査、患者及び家族・介護者から自他覚症状の聴取等による臨床症状の評価を行い、臨床症状
の経過、認知症の重症度等から本剤の有効性が期待できないと考えられる場合は本剤の投与を中止すること。なお、本剤投与中に認知
症の重症度が中等度以降に進行した患者に投与を継続したときの有効性は確立していない。
7.5 本剤投与により、アミロイド関連画像異常(ARIA)としてARIA-浮腫/滲出液貯留(ARIA-E)もしくはARIA-脳微小出血・脳表ヘモジデ
リン沈着症(ARIA-H)、又は脳出血があらわれることがある。
27