よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について[588KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
No.
一般名
薬効
分類
改訂内容
改訂理由
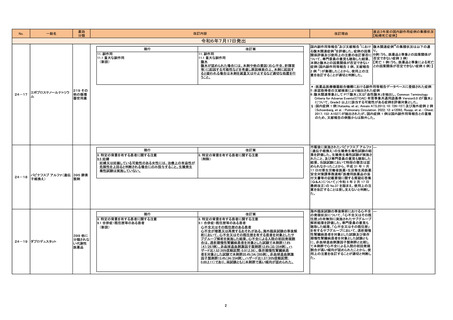
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
令和6年7月17日発出
現行
11. 副作用
11.1 重大な副作用
(新設)
24-17
24-18
エポプロステノールナトリウ
ム
改訂案
11. 副作用
11.1 重大な副作用
腹水
腹水が認められた場合には、本剤や他の要因(右心不全、肝障害
等)に起因する可能性などを考慮し原因検索の上、本剤に起因す
ると疑われる場合は本剤を減量又は中止するなど適切な処置を行
うこと。
*:医薬品医療機器総合機構における副作用等報告データベースに登録された症例
†:承認取得者の文献検索により抽出された症例
‡:腹水関連事象として PT「腹水」又は「血性腹水」を抽出し、Common Terminology
Criteria for Adverse Events(CTCAE) 有害事象共通用語基準 Version5.0 の「腹水」
について、Grade3 以上に該当する可能性がある症例を評価対象とした。
§:国内症例 1 例(Kataoka, et al.: Annals ATS.2013; 10: 726-727)及び海外症例 2 例
(Schoenberg, et al. : Pulmonary Circulation. 2022; 12: e12092, Ruopp, et al. : Chest.
2017; 152: A1027)が抽出されたが、国内症例 1 例は国内副作用等報告との重複
のため、文献報告の例数からは除外した。
219 その
他の循環
器官用薬
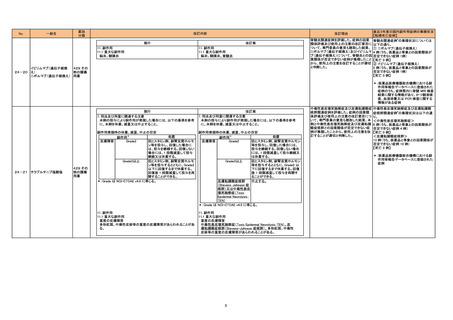
現行
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が
危険性を上回ると判断される場合にのみ投与すること。生殖発生
毒性試験は実施していない。
改訂案
9. 特定の背景を有する患者に関する注意
(削除)
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
心不全又はその既往歴のある患者
心不全が増悪又は再発するおそれがある。海外臨床試験の事後解
析において、心不全又はその既往歴を有する患者を対象としたサ
ブグループ解析を実施した結果、心不全による入院の初回発現割
合は、透析期慢性腎臓病患者を対象とした試験で本剤群17.6%
(47/267例)、赤血球造血刺激因子製剤群12.6%(32/254例)、ハ
ザード比1.52(95%信頼区間:0.97,2.38)、保存期慢性腎臓病患
者を対象とした試験で本剤群20.4%(54/265例)、赤血球造血刺激
因子製剤群13.4%(34/254例)、ハザード比1.37(95%信頼区間:
0.89,2.11)であり、両試験ともに本剤群で高い傾向が認められた。
パビナフスプ アルファ(遺伝 395 酵素
子組換え)
製剤
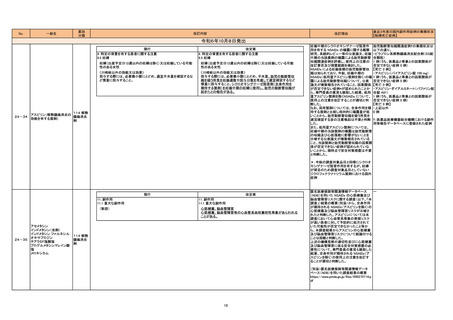
24-19 ダプロデュスタット
399 他に
分類されな
い代謝性
医薬品
国内副作用等報告*及び文献報告 †におけ 腹水関連症例*‡の集積状況は以下の通
る腹水関連症例 ‡を評価した。症例の因果 り。
関係評価及び使用上の注意の改訂要否に 6例(うち、医薬品と事象との因果関係が
ついて、専門委員の意見も聴取した結果、 否定できない症例 3 例)
本剤と腹水との因果関係が否定できない 【死亡 1 例(うち、医薬品と事象による死亡
症例(国内副作用等報告 3 例、文献報告 との因果関係が否定できない症例 0 例)】
2 例 §)が集積したことから、使用上の注
意を改訂することが適切と判断した。
2
市販後に実施されたパビナフスプ アルファ ―
(遺伝子組換え)の生殖発生毒性試験の結
果を評価した。生殖発生毒性試験が実施さ
れたこと、及び専門委員の意見も聴取した
結果、当該試験において特段の懸念は認
められなかったことから、平成 31 年 1 月
17 日付厚生労働省医薬・生活衛生局医薬
安全対策課事務連絡「医療用医薬品の添
付文書等の記載要領に関する質疑応答集
(Q&A)について」(令和 5 年 2 月 17 日
最終改正)の No.37 を踏まえ、使用上の注
意を改訂することは差し支えないと判断し
た。
海外臨床試験の事後解析における心不全 ―
の発現状況について、「心不全又はその既
往歴」の有無別に実施されたサブグループ
解析結果を評価した。専門委員の意見も
聴取した結果、「心不全又はその既往歴」
を有するサブグループにおいて、透析期慢
性腎臓病患者を対象とした試験及び保存
期慢性腎臓病患者を対象とした試験とも
に、赤血球造血刺激因子製剤群と比較し
て本剤群で心不全による入院の初回発現
割合が高い傾向が認められたことから、使
用上の注意を改訂することが適切と判断し
た。
一般名
薬効
分類
改訂内容
改訂理由
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
令和6年7月17日発出
現行
11. 副作用
11.1 重大な副作用
(新設)
24-17
24-18
エポプロステノールナトリウ
ム
改訂案
11. 副作用
11.1 重大な副作用
腹水
腹水が認められた場合には、本剤や他の要因(右心不全、肝障害
等)に起因する可能性などを考慮し原因検索の上、本剤に起因す
ると疑われる場合は本剤を減量又は中止するなど適切な処置を行
うこと。
*:医薬品医療機器総合機構における副作用等報告データベースに登録された症例
†:承認取得者の文献検索により抽出された症例
‡:腹水関連事象として PT「腹水」又は「血性腹水」を抽出し、Common Terminology
Criteria for Adverse Events(CTCAE) 有害事象共通用語基準 Version5.0 の「腹水」
について、Grade3 以上に該当する可能性がある症例を評価対象とした。
§:国内症例 1 例(Kataoka, et al.: Annals ATS.2013; 10: 726-727)及び海外症例 2 例
(Schoenberg, et al. : Pulmonary Circulation. 2022; 12: e12092, Ruopp, et al. : Chest.
2017; 152: A1027)が抽出されたが、国内症例 1 例は国内副作用等報告との重複
のため、文献報告の例数からは除外した。
219 その
他の循環
器官用薬
現行
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が
危険性を上回ると判断される場合にのみ投与すること。生殖発生
毒性試験は実施していない。
改訂案
9. 特定の背景を有する患者に関する注意
(削除)
現行
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
(新設)
改訂案
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
心不全又はその既往歴のある患者
心不全が増悪又は再発するおそれがある。海外臨床試験の事後解
析において、心不全又はその既往歴を有する患者を対象としたサ
ブグループ解析を実施した結果、心不全による入院の初回発現割
合は、透析期慢性腎臓病患者を対象とした試験で本剤群17.6%
(47/267例)、赤血球造血刺激因子製剤群12.6%(32/254例)、ハ
ザード比1.52(95%信頼区間:0.97,2.38)、保存期慢性腎臓病患
者を対象とした試験で本剤群20.4%(54/265例)、赤血球造血刺激
因子製剤群13.4%(34/254例)、ハザード比1.37(95%信頼区間:
0.89,2.11)であり、両試験ともに本剤群で高い傾向が認められた。
パビナフスプ アルファ(遺伝 395 酵素
子組換え)
製剤
24-19 ダプロデュスタット
399 他に
分類されな
い代謝性
医薬品
国内副作用等報告*及び文献報告 †におけ 腹水関連症例*‡の集積状況は以下の通
る腹水関連症例 ‡を評価した。症例の因果 り。
関係評価及び使用上の注意の改訂要否に 6例(うち、医薬品と事象との因果関係が
ついて、専門委員の意見も聴取した結果、 否定できない症例 3 例)
本剤と腹水との因果関係が否定できない 【死亡 1 例(うち、医薬品と事象による死亡
症例(国内副作用等報告 3 例、文献報告 との因果関係が否定できない症例 0 例)】
2 例 §)が集積したことから、使用上の注
意を改訂することが適切と判断した。
2
市販後に実施されたパビナフスプ アルファ ―
(遺伝子組換え)の生殖発生毒性試験の結
果を評価した。生殖発生毒性試験が実施さ
れたこと、及び専門委員の意見も聴取した
結果、当該試験において特段の懸念は認
められなかったことから、平成 31 年 1 月
17 日付厚生労働省医薬・生活衛生局医薬
安全対策課事務連絡「医療用医薬品の添
付文書等の記載要領に関する質疑応答集
(Q&A)について」(令和 5 年 2 月 17 日
最終改正)の No.37 を踏まえ、使用上の注
意を改訂することは差し支えないと判断し
た。
海外臨床試験の事後解析における心不全 ―
の発現状況について、「心不全又はその既
往歴」の有無別に実施されたサブグループ
解析結果を評価した。専門委員の意見も
聴取した結果、「心不全又はその既往歴」
を有するサブグループにおいて、透析期慢
性腎臓病患者を対象とした試験及び保存
期慢性腎臓病患者を対象とした試験とも
に、赤血球造血刺激因子製剤群と比較し
て本剤群で心不全による入院の初回発現
割合が高い傾向が認められたことから、使
用上の注意を改訂することが適切と判断し
た。