よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について[588KB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
No.
一般名
薬効
分類
改訂内容
改訂理由
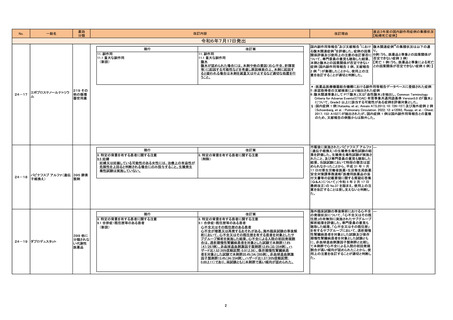
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
令和6年8月27日発出
現行
15. その他の注意
15.1 臨床使用に基づく情報
(新設)
改訂案
15. その他の注意
15.1 臨床使用に基づく情報
本剤との因果関係は明らかではないが、北欧で実施された観察研
究において、受胎前の3ヵ月間に本剤に曝露した父親の児は、ラ
モトリギン又はレベチラセタムに曝露した父親の児と比較して、
神経発達症リスクの増加を示唆する報告がある(調整ハザード比
1.50[95%信頼区間:1.09-2.07])。一方で、てんかんを有する父
親を対象とした海外で実施された観察研究において、受胎前の
120日間に本剤に曝露した父親の児は、本剤に曝露していない父
親の児と比較して、統計学的に有意な神経発達症リスクの増加は
認められないとする報告もある。
【参考】PASS-Paternal exposure to valproate -Updated Abstract Following Reanalysis of Norway Data of Corrigendum to Final
Study Report Version 1.1 and Addendum Version 2 Valproate EU consortium Stand Alone Abstract V2.0:
https://catalogues.ema.europa.eu/system/files/2024-02/Valproate_PASS_Abstract_V2.0_0.pdf
Christensen,J.,et al.:JAMA Netw Open. 2024;7:e2414709
24-24
バルプロ酸ナトリウム
113 抗て
んかん剤
117 精神
神経用剤
本剤に曝露した父親の児における神経発 -
達症に関する海外疫学調査文献を評価し
た。専門委員の意見も聴取した結果、以下
の内容を踏まえ、現時点では本剤に曝露し
た父親の児における神経発達症の発症リ
スクに関する評価は確立していないもの
の、父親曝露による児における神経発達
症の発症の可能性が否定できないため、
使用上の注意を改訂することが適切と判
断した。
北欧観察研究*において、受胎前の 3 ヵ
月間に本剤に曝露した父親の児における
神経発達症リスクの増加が示唆されたこ
と。ただし、欧州ではさらなる検討のため新
たな試験の実施が求められている†。
海外観察研究(JAMA Netw Open. 2024;
7: e2414709)において、受胎前の 120 日
間に本剤に曝露したてんかんを有する父
親の児では、統計学的に有意な神経発達
症リスクの増加は認められないこと。
*:PASS -Paternal exposure to valproate
-Updated Abstract Following Reanalysis of
Norway Data of Corrigendum to Final
Study Report Version 1.1 and Addendum
Version 2 Valproate EU consortium Stand
Alone Abstract_V2.0
(https://catalogues.ema.europa.eu/syste
m/files/202402/Valproate_PASS_Abstract_V2.0_0.pdf)
†:欧州医薬品庁のファーマコビジランス・リ
スク評価委員会 assessment report
(https://www.ema.europa.eu/en/documen
ts/other/valproate-prac-noninterventional-imposed pass-final-studyreport-assessment-report-emea-h-npsr-j-0043_en.pdf)
5
一般名
薬効
分類
改訂内容
改訂理由
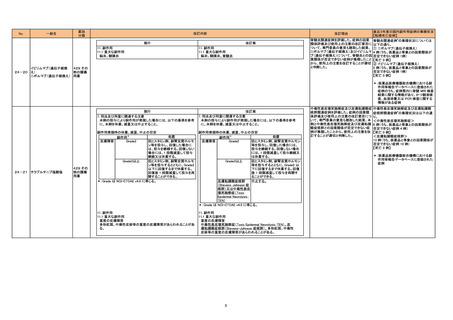
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
令和6年8月27日発出
現行
15. その他の注意
15.1 臨床使用に基づく情報
(新設)
改訂案
15. その他の注意
15.1 臨床使用に基づく情報
本剤との因果関係は明らかではないが、北欧で実施された観察研
究において、受胎前の3ヵ月間に本剤に曝露した父親の児は、ラ
モトリギン又はレベチラセタムに曝露した父親の児と比較して、
神経発達症リスクの増加を示唆する報告がある(調整ハザード比
1.50[95%信頼区間:1.09-2.07])。一方で、てんかんを有する父
親を対象とした海外で実施された観察研究において、受胎前の
120日間に本剤に曝露した父親の児は、本剤に曝露していない父
親の児と比較して、統計学的に有意な神経発達症リスクの増加は
認められないとする報告もある。
【参考】PASS-Paternal exposure to valproate -Updated Abstract Following Reanalysis of Norway Data of Corrigendum to Final
Study Report Version 1.1 and Addendum Version 2 Valproate EU consortium Stand Alone Abstract V2.0:
https://catalogues.ema.europa.eu/system/files/2024-02/Valproate_PASS_Abstract_V2.0_0.pdf
Christensen,J.,et al.:JAMA Netw Open. 2024;7:e2414709
24-24
バルプロ酸ナトリウム
113 抗て
んかん剤
117 精神
神経用剤
本剤に曝露した父親の児における神経発 -
達症に関する海外疫学調査文献を評価し
た。専門委員の意見も聴取した結果、以下
の内容を踏まえ、現時点では本剤に曝露し
た父親の児における神経発達症の発症リ
スクに関する評価は確立していないもの
の、父親曝露による児における神経発達
症の発症の可能性が否定できないため、
使用上の注意を改訂することが適切と判
断した。
北欧観察研究*において、受胎前の 3 ヵ
月間に本剤に曝露した父親の児における
神経発達症リスクの増加が示唆されたこ
と。ただし、欧州ではさらなる検討のため新
たな試験の実施が求められている†。
海外観察研究(JAMA Netw Open. 2024;
7: e2414709)において、受胎前の 120 日
間に本剤に曝露したてんかんを有する父
親の児では、統計学的に有意な神経発達
症リスクの増加は認められないこと。
*:PASS -Paternal exposure to valproate
-Updated Abstract Following Reanalysis of
Norway Data of Corrigendum to Final
Study Report Version 1.1 and Addendum
Version 2 Valproate EU consortium Stand
Alone Abstract_V2.0
(https://catalogues.ema.europa.eu/syste
m/files/202402/Valproate_PASS_Abstract_V2.0_0.pdf)
†:欧州医薬品庁のファーマコビジランス・リ
スク評価委員会 assessment report
(https://www.ema.europa.eu/en/documen
ts/other/valproate-prac-noninterventional-imposed pass-final-studyreport-assessment-report-emea-h-npsr-j-0043_en.pdf)
5