よむ、つかう、まなぶ。
資料2-1 医薬品等の使用上の注意の改訂について[588KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44308.html |
| 出典情報 | 薬事審議会 医薬品等安全対策部会(令和6年度第2回 10/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
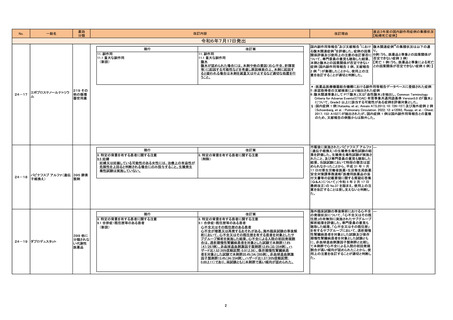
No.
一般名
薬効
分類
改訂内容
現行
11. 副作用
11.1 重大な副作用
脳炎、髄膜炎
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
脊髄炎関連症例を評価した。症例の因果 脊髄炎関連症例*の集積状況については
関係評価及び使用上の注意の改訂要否に 以下の通り。
ついて、専門委員の意見も聴取した結果、 ① ニボルマブ(遺伝子組換え)
ニボルマブ(遺伝子組換え)及びイピリムマ 4 例(うち、医薬品と事象との因果関係が
ブ(遺伝子組換え)について、脊髄炎との因 否定できない症例 1例)
果関係が否定できない症例が集積したこと 【死亡 0 例】
から、使用上の注意を改訂することが適切 ② イピリムマブ(遺伝子組換え)
と判断した。
2 例(うち、医薬品と事象との因果関係が
否定できない症例 1例)
【死亡 0 例】
改訂理由
改訂案
11. 副作用
11.1 重大な副作用
脳炎、髄膜炎、脊髄炎
イピリムマブ(遺伝子組換
429 その
24-20 え)
他の腫瘍
ニボルマブ(遺伝子組換え) 用薬
*:医薬品医療機器総合機構における副
作用等報告データベースに登録された
症例のうち、症例票内に脊髄 MRI 検査
結果に関する情報があり、かつ髄液検
査、血液培養又は PCR 検査に関する
情報がある症例
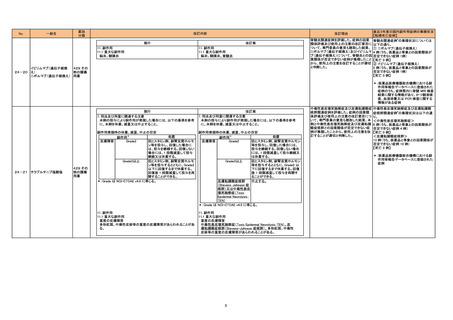
現行
7. 用法及び用量に関連する注意
本剤の投与により副作用が発現した場合には、以下の基準を参考
に、本剤を休薬、減量又は中止すること。
24-21 チラブルチニブ塩酸塩
429 その
他の腫瘍
用薬
改訂案
7. 用法及び用量に関連する注意
本剤の投与により副作用が発現した場合には、以下の基準を参考
に、本剤を休薬、減量又は中止すること。
副作用発現時の休薬、減量、中止の目安
処置
副作用*
皮膚障害
Grade2
抗ヒスタミン剤、副腎皮質ホルモ
ン等を投与し、回復した場合に
は、投与を継続する。回復しない
場合には、1 段階減量して投与
継続又は休薬する。
Grade3以上
抗ヒスタミン剤、副腎皮質ホルモ
ン等を投与するとともに、Grade2
以下に回復するまで休薬する。
回復後 1 段階減量して投与を再
開することができる。
*:Grade は NCI-CTCAE v4.0 に準じる。
副作用発現時の休薬、減量、中止の目安
処置
副作用*
皮膚障害
Grade2
抗ヒスタミン剤、副腎皮質ホルモン
等を投与し、回復した場合には、
投与を継続する。回復しない場合
には、1 段階減量して投与継続又
は休薬する。
Grade3以上
抗ヒスタミン剤、副腎皮質ホルモン
等を投与するとともに、Grade2 以
下に回復するまで休薬する。回復
後 1 段階減量して投与を再開す
ることができる。
皮膚粘膜眼症候群
中止する。
(Stevens Johnson 症
候群)又は中毒性表皮
壊死融解症(Toxic
Epidermal Necrolysis:
TEN)
*:Grade は NCI-CTCAE v4.0 に準じる。
11. 副作用
11.1 重大な副作用
重度の皮膚障害
多形紅斑、中毒性皮疹等の重度の皮膚障害があらわれることがあ
る。
11. 副作用
11.1 重大な副作用
重度の皮膚障害
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮
膚粘膜眼症候群(Stevens-Johnson 症候群)、多形紅斑、中毒性
皮疹等の重度の皮膚障害があらわれることがある。
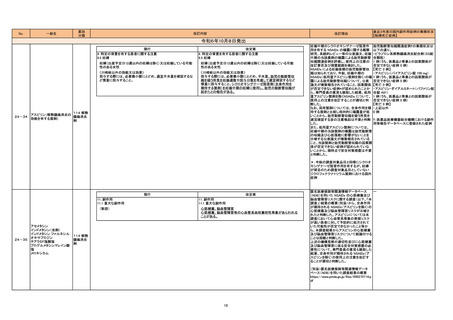
3
中毒性表皮壊死融解症及び皮膚粘膜眼症 中毒性表皮壊死融解症及び皮膚粘膜眼
候群関連症例を評価した。症例の因果関 症候群関連症例*の集積状況は以下の通
係評価及び使用上の注意の改訂要否につ り。
いて、専門委員の意見も聴取した結果、本 <中毒性表皮壊死融解症>
剤と中毒性表皮壊死融解症及び皮膚粘膜 6 例(うち、医薬品と事象との因果関係が
眼症候群との因果関係が否定できない症 否定できない症例 4 例)
例が集積したことから、使用上の注意を改 【死亡 0 例】
訂することが適切と判断した。
<皮膚粘膜眼症候群>
13 例(うち、医薬品と事象との因果関係が
否定できない症例 10 例)
【死亡 0 例】
*:医薬品医療機器総合機構における副
作用等報告データベースに登録された
症例
一般名
薬効
分類
改訂内容
現行
11. 副作用
11.1 重大な副作用
脳炎、髄膜炎
直近3年度の国内副作用症例の集積状況
【転帰死亡症例】
脊髄炎関連症例を評価した。症例の因果 脊髄炎関連症例*の集積状況については
関係評価及び使用上の注意の改訂要否に 以下の通り。
ついて、専門委員の意見も聴取した結果、 ① ニボルマブ(遺伝子組換え)
ニボルマブ(遺伝子組換え)及びイピリムマ 4 例(うち、医薬品と事象との因果関係が
ブ(遺伝子組換え)について、脊髄炎との因 否定できない症例 1例)
果関係が否定できない症例が集積したこと 【死亡 0 例】
から、使用上の注意を改訂することが適切 ② イピリムマブ(遺伝子組換え)
と判断した。
2 例(うち、医薬品と事象との因果関係が
否定できない症例 1例)
【死亡 0 例】
改訂理由
改訂案
11. 副作用
11.1 重大な副作用
脳炎、髄膜炎、脊髄炎
イピリムマブ(遺伝子組換
429 その
24-20 え)
他の腫瘍
ニボルマブ(遺伝子組換え) 用薬
*:医薬品医療機器総合機構における副
作用等報告データベースに登録された
症例のうち、症例票内に脊髄 MRI 検査
結果に関する情報があり、かつ髄液検
査、血液培養又は PCR 検査に関する
情報がある症例
現行
7. 用法及び用量に関連する注意
本剤の投与により副作用が発現した場合には、以下の基準を参考
に、本剤を休薬、減量又は中止すること。
24-21 チラブルチニブ塩酸塩
429 その
他の腫瘍
用薬
改訂案
7. 用法及び用量に関連する注意
本剤の投与により副作用が発現した場合には、以下の基準を参考
に、本剤を休薬、減量又は中止すること。
副作用発現時の休薬、減量、中止の目安
処置
副作用*
皮膚障害
Grade2
抗ヒスタミン剤、副腎皮質ホルモ
ン等を投与し、回復した場合に
は、投与を継続する。回復しない
場合には、1 段階減量して投与
継続又は休薬する。
Grade3以上
抗ヒスタミン剤、副腎皮質ホルモ
ン等を投与するとともに、Grade2
以下に回復するまで休薬する。
回復後 1 段階減量して投与を再
開することができる。
*:Grade は NCI-CTCAE v4.0 に準じる。
副作用発現時の休薬、減量、中止の目安
処置
副作用*
皮膚障害
Grade2
抗ヒスタミン剤、副腎皮質ホルモン
等を投与し、回復した場合には、
投与を継続する。回復しない場合
には、1 段階減量して投与継続又
は休薬する。
Grade3以上
抗ヒスタミン剤、副腎皮質ホルモン
等を投与するとともに、Grade2 以
下に回復するまで休薬する。回復
後 1 段階減量して投与を再開す
ることができる。
皮膚粘膜眼症候群
中止する。
(Stevens Johnson 症
候群)又は中毒性表皮
壊死融解症(Toxic
Epidermal Necrolysis:
TEN)
*:Grade は NCI-CTCAE v4.0 に準じる。
11. 副作用
11.1 重大な副作用
重度の皮膚障害
多形紅斑、中毒性皮疹等の重度の皮膚障害があらわれることがあ
る。
11. 副作用
11.1 重大な副作用
重度の皮膚障害
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮
膚粘膜眼症候群(Stevens-Johnson 症候群)、多形紅斑、中毒性
皮疹等の重度の皮膚障害があらわれることがある。
3
中毒性表皮壊死融解症及び皮膚粘膜眼症 中毒性表皮壊死融解症及び皮膚粘膜眼
候群関連症例を評価した。症例の因果関 症候群関連症例*の集積状況は以下の通
係評価及び使用上の注意の改訂要否につ り。
いて、専門委員の意見も聴取した結果、本 <中毒性表皮壊死融解症>
剤と中毒性表皮壊死融解症及び皮膚粘膜 6 例(うち、医薬品と事象との因果関係が
眼症候群との因果関係が否定できない症 否定できない症例 4 例)
例が集積したことから、使用上の注意を改 【死亡 0 例】
訂することが適切と判断した。
<皮膚粘膜眼症候群>
13 例(うち、医薬品と事象との因果関係が
否定できない症例 10 例)
【死亡 0 例】
*:医薬品医療機器総合機構における副
作用等報告データベースに登録された
症例