よむ、つかう、まなぶ。
【参考資料2】これまでの議論で出された主な意見.pdf (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
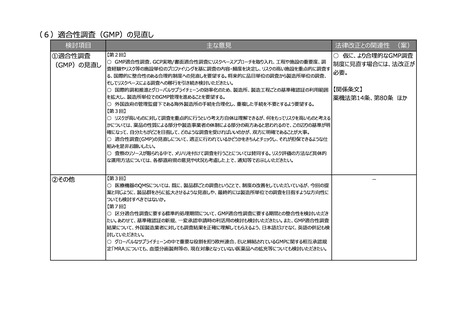
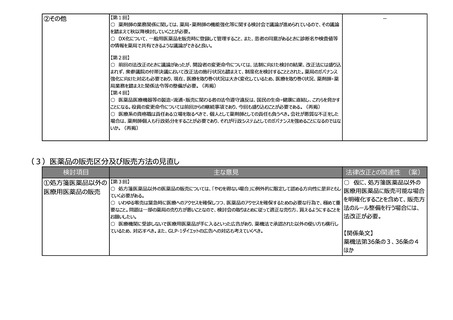
②その他
-
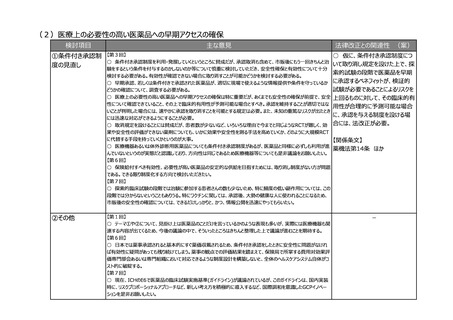
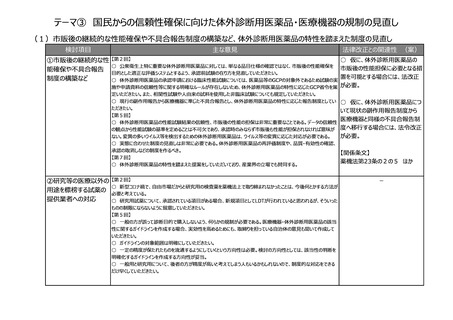
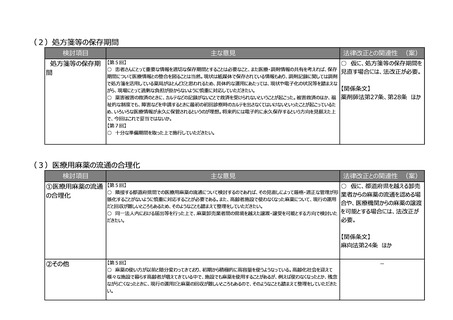
【第1回】
○ 市販後安全性調査に関して、早期承認や緊急承認等をして、いち早く供給をしたまではいいものの、その後の安全
性、有効性の再確認に資するようなデータの蓄積と、その内容の標準化が明確に確認できるきちんとした信頼性の高い
データベースが、いまだに十分に存在していないようにも思われる。長年の指摘事項であるため、改めて御検討いただきた
い。
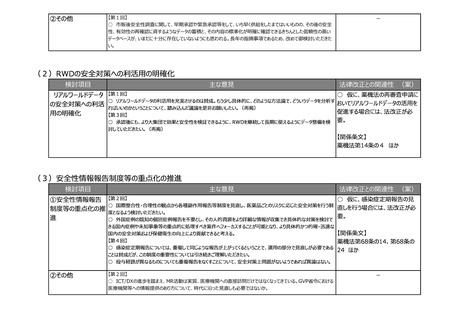
(2)RWDの安全対策への利活用の明確化
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、薬機法の再審査申請に
リアルワールドデータ 【第1回】
○ リアルワールドデータの利活用を充実させるのは賛成。もう少し具体的に、どのような方法論で、どういうデータを分析す
おいてリアルワールドデータの活用を
の安全対策への利活
ればいいのかということについて、踏み込んだ議論を是非お願いしたい。(再掲)
促進する場合には、法改正が必
用の明確化
【第3回】
○ 承認後にも、より大集団で効果と安全性を検証できるように、RWDを継続して長期に使えるようにデータ整備を検
討していただきたい。(再掲)
要。
【関係条文】
薬機法第14条の4 ほか
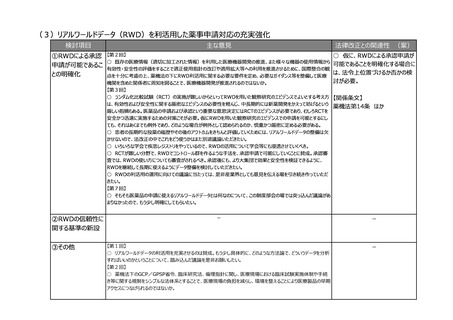
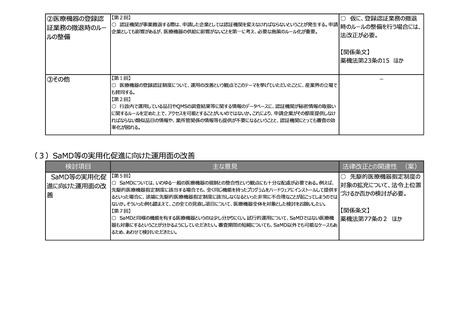
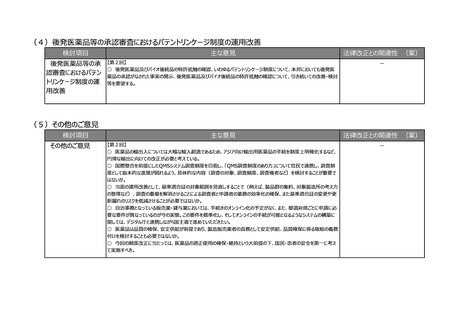
(3)安全性情報報告制度等の重点化の推進
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、感染症定期報告の見
①安全性情報報告 【第2回】
○ 国際整合性・合理性の観点から各種副作用報告等制度を見直し、医薬品ごとのリスクに応じた安全対策を行う制
直しを行う場合には、法改正が必
制度等の重点化の推
度となるよう検討いただきたい。
要。
進
○ 外国症例の既知の個別症例報告を不要とし、その人的資源をより詳細な情報が収集でき具体的な対策を検討で
きる国内症例や未知事象等の重点的に処理すべき案件へフォーカスすることが可能となり、より具体的かつ的確・迅速な
【関係条文】
国内の安全対策および保健衛生の向上により貢献できると考える。
【第4回】
薬機法第68条の14、第68条の
○ 感染症定期報告については、重複して同じような報告が上がってくるということで、運用の部分で見直しが必要である
24 ほか
ことは賛成だが、この制度の重要性については引き続きご理解いただきたい。
○ 投与経路が異なるものについても重複報告をなくすことについて、安全対策上問題がないようであれば異論はない。
②その他
【第2回】
○ ICT/DXの進歩を踏まえ、MR活動は実質、医療機関への直接訪問だけではなくなってきている。GVP省令における
医療機関等への情報提供のあり方について、時代に沿った見直しも必要ではないか。
-12-
-
-
【第1回】
○ 市販後安全性調査に関して、早期承認や緊急承認等をして、いち早く供給をしたまではいいものの、その後の安全
性、有効性の再確認に資するようなデータの蓄積と、その内容の標準化が明確に確認できるきちんとした信頼性の高い
データベースが、いまだに十分に存在していないようにも思われる。長年の指摘事項であるため、改めて御検討いただきた
い。
(2)RWDの安全対策への利活用の明確化
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、薬機法の再審査申請に
リアルワールドデータ 【第1回】
○ リアルワールドデータの利活用を充実させるのは賛成。もう少し具体的に、どのような方法論で、どういうデータを分析す
おいてリアルワールドデータの活用を
の安全対策への利活
ればいいのかということについて、踏み込んだ議論を是非お願いしたい。(再掲)
促進する場合には、法改正が必
用の明確化
【第3回】
○ 承認後にも、より大集団で効果と安全性を検証できるように、RWDを継続して長期に使えるようにデータ整備を検
討していただきたい。(再掲)
要。
【関係条文】
薬機法第14条の4 ほか
(3)安全性情報報告制度等の重点化の推進
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、感染症定期報告の見
①安全性情報報告 【第2回】
○ 国際整合性・合理性の観点から各種副作用報告等制度を見直し、医薬品ごとのリスクに応じた安全対策を行う制
直しを行う場合には、法改正が必
制度等の重点化の推
度となるよう検討いただきたい。
要。
進
○ 外国症例の既知の個別症例報告を不要とし、その人的資源をより詳細な情報が収集でき具体的な対策を検討で
きる国内症例や未知事象等の重点的に処理すべき案件へフォーカスすることが可能となり、より具体的かつ的確・迅速な
【関係条文】
国内の安全対策および保健衛生の向上により貢献できると考える。
【第4回】
薬機法第68条の14、第68条の
○ 感染症定期報告については、重複して同じような報告が上がってくるということで、運用の部分で見直しが必要である
24 ほか
ことは賛成だが、この制度の重要性については引き続きご理解いただきたい。
○ 投与経路が異なるものについても重複報告をなくすことについて、安全対策上問題がないようであれば異論はない。
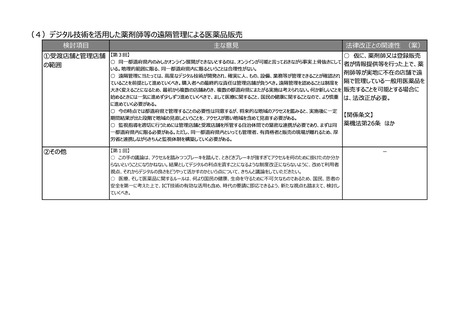
②その他
【第2回】
○ ICT/DXの進歩を踏まえ、MR活動は実質、医療機関への直接訪問だけではなくなってきている。GVP省令における
医療機関等への情報提供のあり方について、時代に沿った見直しも必要ではないか。
-12-
-