よむ、つかう、まなぶ。
【参考資料2】これまでの議論で出された主な意見.pdf (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
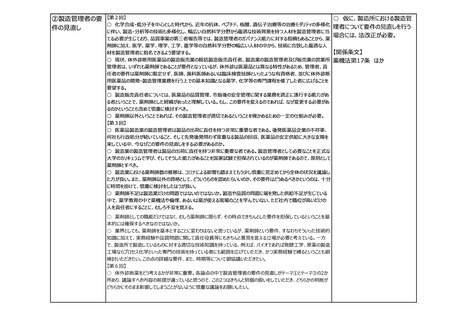
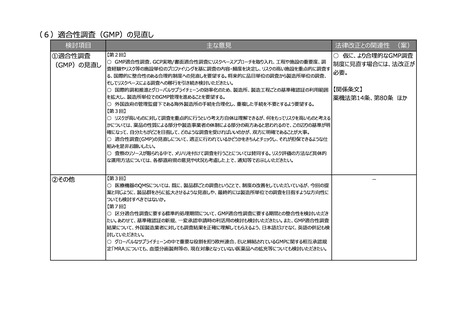
②製造方法等の中
リスクの変更カテゴリ
の追加等
【第2回】
○ 仮に、製造方法等に係る中リ
○ 欧米に遅れることなく医薬品の製造方法等の変更・改良を行えるよう、短期間の確認で変更ができる中等度変更
スクの変更カテゴリを設ける場合に
制度を新たな変更カテゴリーとして導入いただきたい。
は、法改正が必要。
【第7回】
○ 中等度の変更事項について、都道府県のGMP調査にも影響が出る場合には、各県の体制状況も考慮して制度
【関係条文】
化していただきたい。
○ 製造方法等に係る軽微変更の報告について、知事承認も対象に入るということであれば、事前に調整をしていただ 薬機法第14条 ほか
きたい。
③その他
【第3回】
○ 医療機器についても、安定供給の確保という観点で部材の変更あるいは製造所の変更といったところで医薬品とは
少し違う観点での変更が必要になってくるため、別途御相談、議論をさせていただきたい。
【第7回】
○ 日本薬局方の整合性について、日米欧の3極で、共通の制度を作っていくことが最終的な目的であるため、専門家
の科学的な議論が最終的には重要。
○ 日本薬局方の国際整合性の確保に向けた対応も非常に重要で、前提として日本薬局方が適切に利用されること
が必要。
-
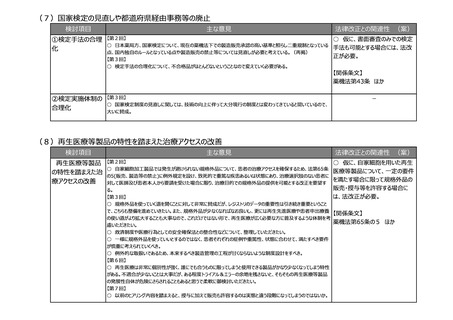
(5)医薬品製造業における許可制度の見直し
検討項目
①製造所の登録制
度の拡大
主な意見
【第3回】
○ 製造所の登録制度は時代の変化とともに変えていく必要がある。
法律改正との関連性 (案)
○ 仮に、登録制度が認められる
保管のみを行う製造所の範囲を拡
大するとともに、海外製造所につい
て認定制ではなく登録制とする場
合には、法改正が必要。
【関係条文】
薬機法第13条 ほか
-6-
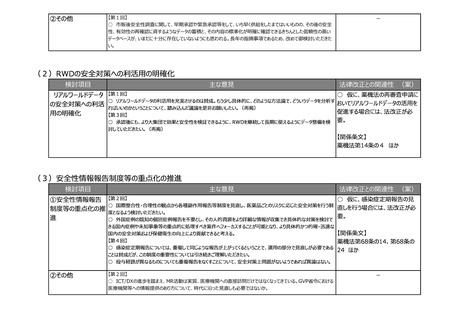
リスクの変更カテゴリ
の追加等
【第2回】
○ 仮に、製造方法等に係る中リ
○ 欧米に遅れることなく医薬品の製造方法等の変更・改良を行えるよう、短期間の確認で変更ができる中等度変更
スクの変更カテゴリを設ける場合に
制度を新たな変更カテゴリーとして導入いただきたい。
は、法改正が必要。
【第7回】
○ 中等度の変更事項について、都道府県のGMP調査にも影響が出る場合には、各県の体制状況も考慮して制度
【関係条文】
化していただきたい。
○ 製造方法等に係る軽微変更の報告について、知事承認も対象に入るということであれば、事前に調整をしていただ 薬機法第14条 ほか
きたい。
③その他
【第3回】
○ 医療機器についても、安定供給の確保という観点で部材の変更あるいは製造所の変更といったところで医薬品とは
少し違う観点での変更が必要になってくるため、別途御相談、議論をさせていただきたい。
【第7回】
○ 日本薬局方の整合性について、日米欧の3極で、共通の制度を作っていくことが最終的な目的であるため、専門家
の科学的な議論が最終的には重要。
○ 日本薬局方の国際整合性の確保に向けた対応も非常に重要で、前提として日本薬局方が適切に利用されること
が必要。
-
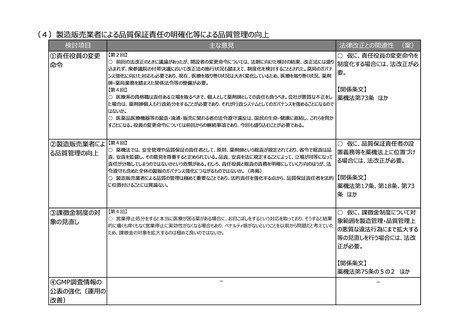
(5)医薬品製造業における許可制度の見直し
検討項目
①製造所の登録制
度の拡大
主な意見
【第3回】
○ 製造所の登録制度は時代の変化とともに変えていく必要がある。
法律改正との関連性 (案)
○ 仮に、登録制度が認められる
保管のみを行う製造所の範囲を拡
大するとともに、海外製造所につい
て認定制ではなく登録制とする場
合には、法改正が必要。
【関係条文】
薬機法第13条 ほか
-6-