よむ、つかう、まなぶ。
【参考資料2】これまでの議論で出された主な意見.pdf (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_44832.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第8回 10/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
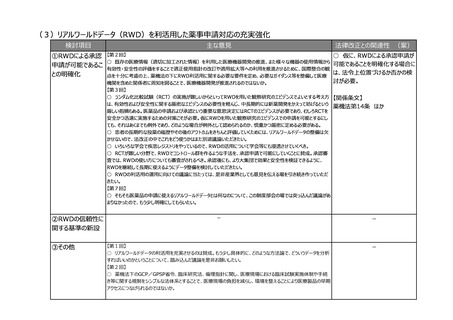
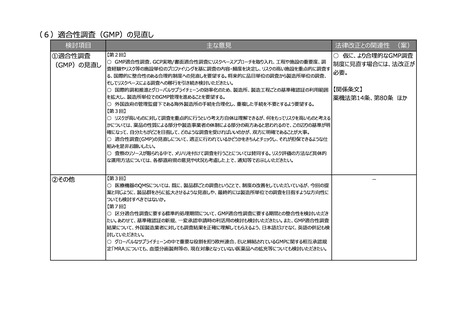
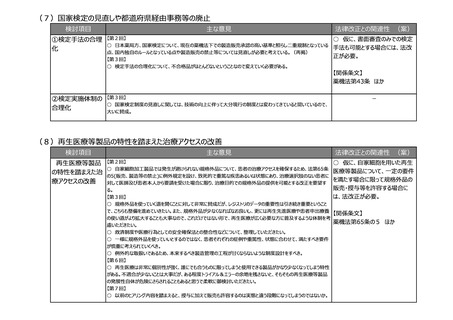
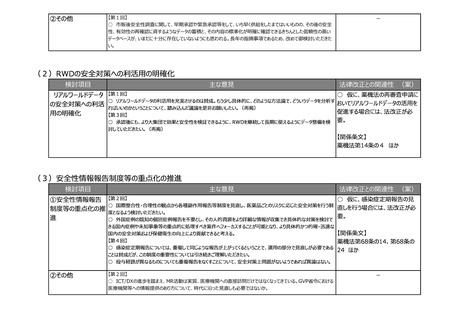
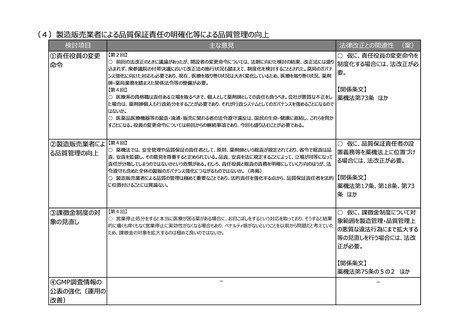
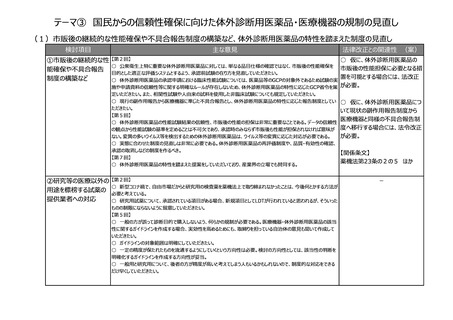
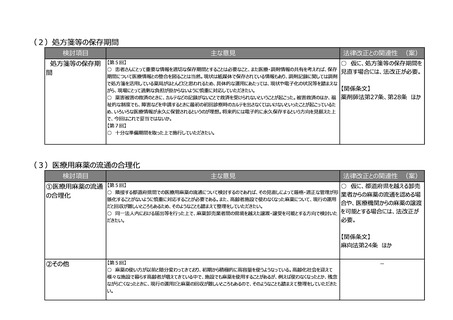
(3)リアルワールドデータ(RWD)を利活用した薬事申請対応の充実強化
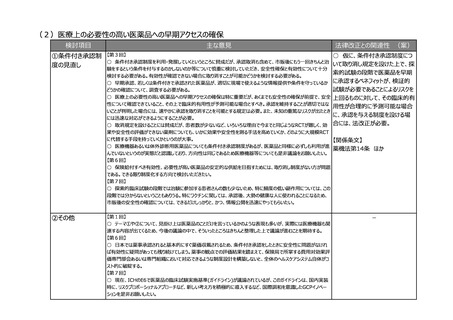
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、RWDによる承認申請が
①RWDによる承認 【第2回】
○ 既存の医療情報(適切に加工された情報)を利用した医療機器開発の推進、また様々な機器の使用情報から
可能であることを明確化する場合に
申請が可能であるこ
有効性・安全性の評価をすることで適正使用指針の改訂や適用拡大等への利用を推進させるために、国際整合の観
は、法令上位置づけるか否かの検
との明確化
点を十分に考慮の上、薬機法の下にRWD利活用に関する必要な要件を定め、必要なガイダンス等を整備して医療
討が必要。
機関を含めた関係者に周知を図ることで、医療機器開発が推進されるのではないか。
【第3回】
○ ランダム化比較試験(RCT)の実施が難しいからといってRWDを用いた観察研究のエビデンスでよいとする考え方 【関係条文】
は、有効性および安全性に関する厳密なエビデンスの必要性を軽んじ、中長期的には新薬開発をかえって妨げるという
薬機法第14条
厳しい指摘もある。医薬品の申請および承認という重要な意思決定にはRCTのエビデンスが必要であり、むしろRCTを
安全かつ迅速に実施するための対策こそが必要。仮にRWDを用いた観察研究のエビデンスでの申請を可能とするにし
ても、それはあくまでも例外であり、どのような場合が例外として認められるのか、慎重かつ厳密に定める必要がある。
○ 患者の長期的な投薬の履歴やその後のアウトカムをきちんと評価していくためには、リアルワールドデータの整備は欠
かせないので、法改正の中でこれをどう使うかはまた別途議論いただきたい。
○ いろいろな学会で疾患レジストリをやっているので、RWDの活用について学会等にも浸透させていくべき。
○ RCTが難しい分野で、RWDでコントロール群を作るような手法を、承認申請で可能にしていくことに賛成。承認審
査では、RWDの使い方についても審査がされるべき。承認後にも、より大集団で効果と安全性を検証できるように、
RWDを継続して長期に使えるようにデータ整備を検討していただきたい。
○ RWDの利活用の運用に向けての議論に当たっては、是非産業界としても意見を伝える場を引き続き作っていただ
きたい。
【第7回】
○ そもそも医薬品の申請に使えるリアルワールドデータとは何なのについて、この制度部会の場では突っ込んだ議論があ
まりなかったので、もう少し明確にしてもらいたい。
②RWDの信頼性に
関する基準の新設
③その他
ほか
ー
-
【第1回】
○ リアルワールドデータの利活用を充実させるのは賛成。もう少し具体的に、どのような方法論で、どういうデータを分析
すればいいのかということについて、踏み込んだ議論を是非お願いしたい。
【第2回】
○ 薬機法下のGCP/GPSP省令、臨床研究法、倫理指針に関し、医療現場における臨床試験実施体制や手続
き等に関する規制をシンプルな法体系とすることで、医療現場の負担を減らし、環境を整えることにより医療製品の早期
アクセスにつなげられるのではないか。
-
-4-
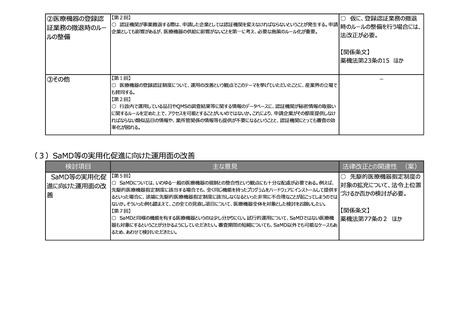
検討項目
主な意見
法律改正との関連性 (案)
○ 仮に、RWDによる承認申請が
①RWDによる承認 【第2回】
○ 既存の医療情報(適切に加工された情報)を利用した医療機器開発の推進、また様々な機器の使用情報から
可能であることを明確化する場合に
申請が可能であるこ
有効性・安全性の評価をすることで適正使用指針の改訂や適用拡大等への利用を推進させるために、国際整合の観
は、法令上位置づけるか否かの検
との明確化
点を十分に考慮の上、薬機法の下にRWD利活用に関する必要な要件を定め、必要なガイダンス等を整備して医療
討が必要。
機関を含めた関係者に周知を図ることで、医療機器開発が推進されるのではないか。
【第3回】
○ ランダム化比較試験(RCT)の実施が難しいからといってRWDを用いた観察研究のエビデンスでよいとする考え方 【関係条文】
は、有効性および安全性に関する厳密なエビデンスの必要性を軽んじ、中長期的には新薬開発をかえって妨げるという
薬機法第14条
厳しい指摘もある。医薬品の申請および承認という重要な意思決定にはRCTのエビデンスが必要であり、むしろRCTを
安全かつ迅速に実施するための対策こそが必要。仮にRWDを用いた観察研究のエビデンスでの申請を可能とするにし
ても、それはあくまでも例外であり、どのような場合が例外として認められるのか、慎重かつ厳密に定める必要がある。
○ 患者の長期的な投薬の履歴やその後のアウトカムをきちんと評価していくためには、リアルワールドデータの整備は欠
かせないので、法改正の中でこれをどう使うかはまた別途議論いただきたい。
○ いろいろな学会で疾患レジストリをやっているので、RWDの活用について学会等にも浸透させていくべき。
○ RCTが難しい分野で、RWDでコントロール群を作るような手法を、承認申請で可能にしていくことに賛成。承認審
査では、RWDの使い方についても審査がされるべき。承認後にも、より大集団で効果と安全性を検証できるように、
RWDを継続して長期に使えるようにデータ整備を検討していただきたい。
○ RWDの利活用の運用に向けての議論に当たっては、是非産業界としても意見を伝える場を引き続き作っていただ
きたい。
【第7回】
○ そもそも医薬品の申請に使えるリアルワールドデータとは何なのについて、この制度部会の場では突っ込んだ議論があ
まりなかったので、もう少し明確にしてもらいたい。
②RWDの信頼性に
関する基準の新設
③その他
ほか
ー
-
【第1回】
○ リアルワールドデータの利活用を充実させるのは賛成。もう少し具体的に、どのような方法論で、どういうデータを分析
すればいいのかということについて、踏み込んだ議論を是非お願いしたい。
【第2回】
○ 薬機法下のGCP/GPSP省令、臨床研究法、倫理指針に関し、医療現場における臨床試験実施体制や手続
き等に関する規制をシンプルな法体系とすることで、医療現場の負担を減らし、環境を整えることにより医療製品の早期
アクセスにつなげられるのではないか。
-
-4-