資料3-2 製造販売業者からの国内副作用等報告の状況 (491 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
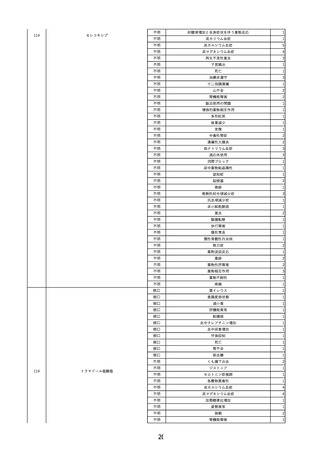
報告受領日
販売名(一般名)
患者
性別
年代
原疾患(簡略名)
感染症名
投与年月
投与前検査(年月)
企業投与前
検査
投与後検査(年月)
企業投与後
検査
受血者個別NAT
献血者個別NAT
備考
輸血開始40分後 輸血終了。BT 36.9℃、BP 112/58 mmHg、HR 79 /min、SpO2 97%。
輸血終了1時間後 悪寒出現。BT 37.4℃、BP 140/72 mmHg、HR 93 /min、SpO2 97%。d-クロルフェニラミンマレイン酸塩投与。COVID-19
抗原検査の結果、陰性。
輸血終了2時間10分後 戦慄あり。血液培養検査実施。ヒドロコルチゾンリン酸エステルナトリウム100 mg 静脈内投与。セフェピム塩酸塩水
和物 1 g 静脈内点滴投与。
輸血終了2時間40分後 BT 40.5℃、BP 96/38 mmHg、HR 95 /min、SpO2 90%。O2 2 L/min開始。嘔吐あり。
SpO2 94%(O2 2 L/min)。
輸血終了3時間40分後 入院。喘鳴あり。BT 38.9℃、BP 101/49 mmHg、HR 86 /min、SpO2 97%(O2 2 L/min)。アドレナリン 0.3 アンプル
皮下注射投与。ファモチジン 20 mg静脈内点滴投与。
輸血終了6時間10分後 BT 38.8℃、BP 73/46 mmHg、HR 98 /min、SpO2 96%(O2 1 L/min)。補液投与。
輸血終了9時間10分後 BP 66/42 mmHg。ノルアドレナリン開始。
輸血翌日 BT 37.5℃、BP 77/49 mmHg(ノルアドレナリン0.25γ投与下)、HR 93 /min、SpO2 97%(O2 カヌラ 1 L/min)。
体温測定2時間17分後 BT 37.5℃、BP 86/61 mmHg。バンコマイシン塩酸塩投与開始。
輸血日実施の患者血液培養検査より、グラム陽性球菌を検出。
11
照射濃厚血小板-LR(人血小板濃
2022/3/14
厚液(放射線照射))
女
血液腫瘍
循環器疾患
70
循環器疾患
腎・泌尿器系疾患
レンサ球菌性
22/03
敗血症
輸血前 BT 36.5℃、BP 110/66 mmHg、
HR 81 /min。
輸血2日後 レボフロキサシン+ダプトマイシンに変更。血圧はノルアドレナリン投与下で安定。
HR 150-160 /minに増加(心房粗動)。酸素化悪化。ベラパミル塩酸塩、ジゴキシンに反応せず。
心拍測定1時間20分後 BT 37.4℃、BP 102/70 mmHg(ノルアドレナリン0.16 γ投与下)、HR 170 /min(心房細動)、SpO2 95%(O2 カヌラ 3
L/min)。
除細動。
調査中
非侵襲的陽圧換気療法(NIPPV)開始。
-
-
-
-
輸血3日後 BT 37.8℃、BP 107/71 mmHg(ノルアドレナリン0.2 γ投与下)、HR 147 /min(心房細動)、SpO2 95%(O2 NIPPV 3 L/min)。
再び、心房粗動。ランジオロール塩酸塩投与でレートコントロール。
輸血4日後 BT 37.6℃、BP 155/77 mmHg、HR 74 /min、SpO2 92%(O2 NIPPV 4 L/min)。ノルアドレナリン終了。
輸血日実施の患者血液培養より、Streptococcus dysgalactiae ssp. equisimilis を同定。
ペニシリンに感受性あり、抗生剤アンピシリンナトリウムに変更。
輸血5日後 BT 37℃台まで解熱。NIPPV終了。
BT 37.4℃、BP 112/67 mmHg、HR 78 /min(心房細動)、SpO2 96%(O2 カヌラ 3 L/min)。
輸血6日後 BT 37.0℃、BP 151/83 mmHg、HR 78 /min(心房細動)、SpO2 98%(O2 カヌラ 1 L/min)。
輸血7日後 BT 37.2℃、BP 126/72 mmHg、HR 102 /min(心房細動)、SpO2 96%(O2 カヌラ 1 L/min)。
輸血8日後 BT 36.4℃、BP 99/55 mmHg、HR 84 /min(心房細動)、SpO2 97%(O2 カヌラ 1 L/min)。
輸血9日後 BT 36.7℃、BP 113/60 mmHg、HR 74 /min(心房細動)、SpO2 95%(O2 カヌラ 1 L/min)。
輸血10日後 BT 35.9℃、BP 106/56 mmHg、HR 71 /min(心房細動)、SpO2 96%(O2 カヌラ 1 L/min)。
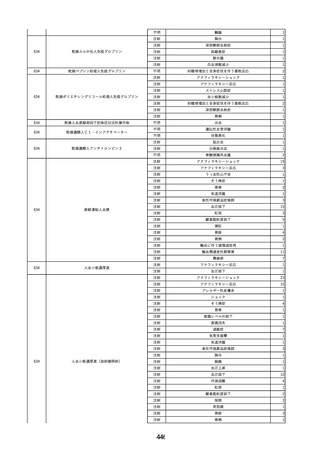
12
13
14
2021/12/8
コンコエイト-HT(乾燥濃縮人血液凝
男
固第8因子)
2021/12/24 アルブミナー(人血清アルブミン)
2021/12/24
男
フィブロガミンP(ヒト血漿由来乾燥血
男
液凝固第13因子 )
40 血液疾患
60
60
循環器疾患
循環器疾患
肝・胆・膵疾患
消化器腫瘍
C型肝炎
HIV感染
-
B型肝炎
B型肝炎表面
抗体
B型肝炎e抗
原陽性
02/09
B型肝炎e抗
体陽性
B型肝炎コア
抗体陽性
検査結果偽陽
03/04
性
-
感染源は、献血由来の凝固因子製剤であると想定された。
-
-
1. 当該製品のウイルス安全
性について
当該製品に使用されている原
料血漿は、各種ウイルス検査
が陰性である登録されたド
ナーから採取されている。 原
料血漿供給元である採血セ
ンターでは、供血者毎に血清
学的検査によりHBs抗原が陰
性であることを確認している。
ミニプール血漿及び製造プー
ル血漿においては、NATによ
りHBVが陰性であることを確
認している。
HBs抗原:RPHA<8、 HBs抗体:PHA<
8、HCV(-)
(02/09)
-
HBs抗体/PHA:8以下、HBe抗原 RIA法:+(カットオフインデックス6.0)、 HBe抗体/RIA:+-(阻害率67.7%)
HBc抗体/CLIA:+(S/CO:7.79)、HBc抗体 IgM:+(カットオフインデックス7.2)、HA抗体/EIA:-、HA抗体 IgM/EIA:-
(03/04)
本剤投与後6ヶ月にC型肝炎陽転。
-
-
490
-
-
-
-
2. 製造工程中でのウイルス
除去・不活化
当該製品の製造工程中に
は、60℃、10時間液状加熱処
理(パスツリゼーション)等の
ウイルス除去・不活化工程が
組み込まれている。また、製
造工程におけるウイルス除
去・不活化を確認するため
に、モデルウイルスを用いた
ウイルスバリデーション試験
を行い、「血漿分画製剤のウ
イルス安全対策について」
(平成15年11月7日付 厚生労
働省医薬食品局 4課長連名
通知 第1107001号)におい
て、ウイルスが十分に除去・
不活化されていると判断され
たウイルスクリアランス指数9
以上が得られることを確認し
ている。
1. 当該製品のウイルス安全
性について
当該製品に使用されている原
料血漿は、各種ウイルス検査
が陰性である登録されたド
ナーから採取されている。 原
料血漿供給元である採血セ
ンターでは、供血者毎に血清
学的検査によりHBs抗原が陰
性であることを確認している。
ミニプール血漿及び製造プー
ル血漿においては、NATによ
りHBVが陰性であることを確
認している。
2. 製造工程中でのウイルス
除去・不活化
当該製品の製造工程中に
は、60℃、10時間液状加熱処
理(パスツリゼーション)等の
ウイルス除去・不活化工程が
組み込まれている。また、製
造工程におけるウイルス除
去・不活化を確認するため
に、モデルウイルスを用いた
ウイルスバリデーション試験
を行い、「血漿分画製剤のウ
イルス安全対策について」
(平成15年11月7日付 厚生労
働省医薬食品局 4課長連名
通知 第1107001号)におい
て、ウイルスが十分に除去・
不活化されていると判断され
たウイルスクリアランス指数
10以上が得られることを確認
している。
投与された血液凝固因子製剤は過去の血液凝固因子製剤であると考えら
れ、現在の製剤による感染症報告ではない。