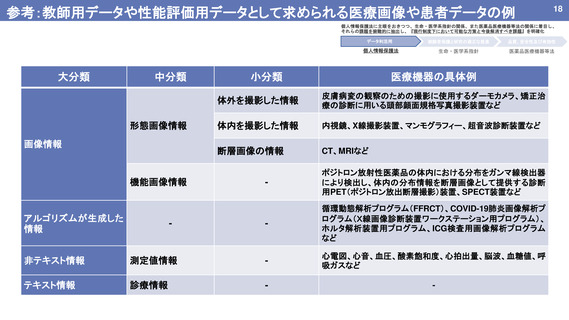
よむ、つかう、まなぶ。
資料1 AI を活用した医療機器の開発・研究におけるデータ利用の実態把握と課題抽出に資する研究 研究班における検討結果 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26840.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(タスクフォース第6回 6/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
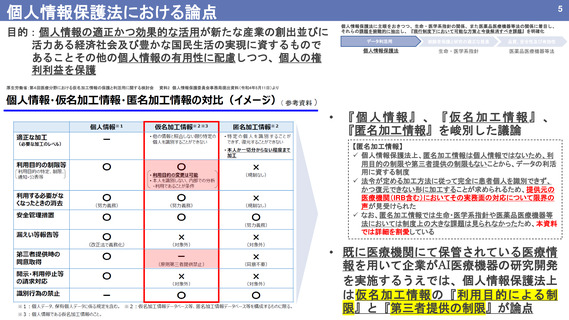
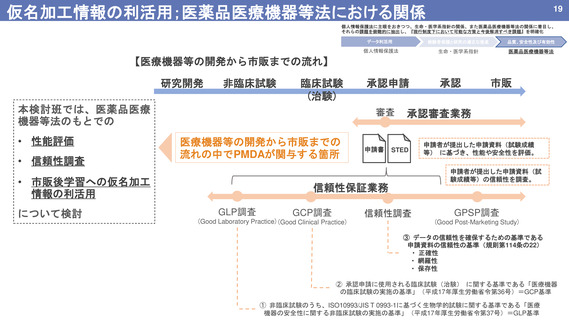
仮名加工情報の利活用;医薬品医療機器等法における関係
19
個人情報保護法に主眼をおきつつ、生命・医学系指針の関係、また医薬品医療機器等法の関係に着目し、
それらの課題を俯瞰的に抽出し、『現行制度下において可能な方策と今後解消すべき課題』を明確化
データ利活用
被験者保護と研究の適正な推進
品質、安全性及び有効性
個人情報保護法
生命・医学系指針
医薬品医療機器等法
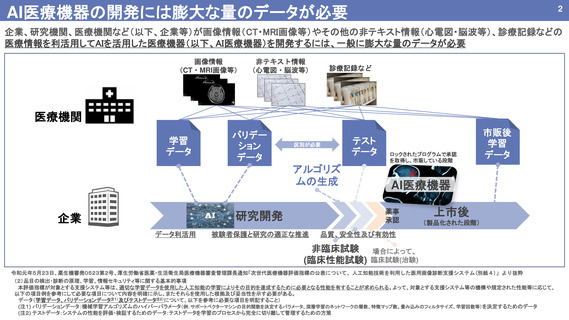
【医療機器等の開発から市販までの流れ】
研究開発
非臨床試験
臨床試験
(治験)
本検討班では、医薬品医療
機器等法のもとでの
• 性能評価
• 信頼性調査
審査
医療機器等の開発から市販までの
流れの中でPMDAが関与する箇所
• 市販後学習への仮名加工
情報の利活用
について検討
承認申請
申請書
STED
申請者が提出した申請資料(試験成績
等) に基づき、性能や安全性を評価。
申請者が提出した申請資料(試
験成績等)の信頼性を調査。
信頼性調査
GCP調査
(Good Laboratory Practice)(Good Clinical Practice)
市販
承認審査業務
信頼性保証業務
GLP調査
承認
GPSP調査
(Good Post-Marketing Study)
③ データの信頼性を確保するための基準である
申請資料の信頼性の基準(規則第114条の22)
・ 正確性
・ 網羅性
・ 保存性
② 承認申請に使用される臨床試験(治験) に関する基準である「医療機器
の臨床試験の実施の基準」(平成17年厚生労働省令第36号)=GCP基準
① 非臨床試験のうち、ISO10993/JIS T 0993-1に基づく生物学的試験に関する基準である「医療
機器の安全性に関する非臨床試験の実施の基準」(平成17年厚生労働省令第37号)=GLP基準
19
個人情報保護法に主眼をおきつつ、生命・医学系指針の関係、また医薬品医療機器等法の関係に着目し、
それらの課題を俯瞰的に抽出し、『現行制度下において可能な方策と今後解消すべき課題』を明確化
データ利活用
被験者保護と研究の適正な推進
品質、安全性及び有効性
個人情報保護法
生命・医学系指針
医薬品医療機器等法
【医療機器等の開発から市販までの流れ】
研究開発
非臨床試験
臨床試験
(治験)
本検討班では、医薬品医療
機器等法のもとでの
• 性能評価
• 信頼性調査
審査
医療機器等の開発から市販までの
流れの中でPMDAが関与する箇所
• 市販後学習への仮名加工
情報の利活用
について検討
承認申請
申請書
STED
申請者が提出した申請資料(試験成績
等) に基づき、性能や安全性を評価。
申請者が提出した申請資料(試
験成績等)の信頼性を調査。
信頼性調査
GCP調査
(Good Laboratory Practice)(Good Clinical Practice)
市販
承認審査業務
信頼性保証業務
GLP調査
承認
GPSP調査
(Good Post-Marketing Study)
③ データの信頼性を確保するための基準である
申請資料の信頼性の基準(規則第114条の22)
・ 正確性
・ 網羅性
・ 保存性
② 承認申請に使用される臨床試験(治験) に関する基準である「医療機器
の臨床試験の実施の基準」(平成17年厚生労働省令第36号)=GCP基準
① 非臨床試験のうち、ISO10993/JIS T 0993-1に基づく生物学的試験に関する基準である「医療
機器の安全性に関する非臨床試験の実施の基準」(平成17年厚生労働省令第37号)=GLP基準