資料1-2-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について (101 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00055.html |
| 出典情報 | 第 88 回厚生科学審議会予防接種・ワクチン分科会 副反応検討部会、令和4年度第 18 回薬事・食品衛生審 議会薬事分科会医薬品等安全対策部会安全対策調査会(11/11)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
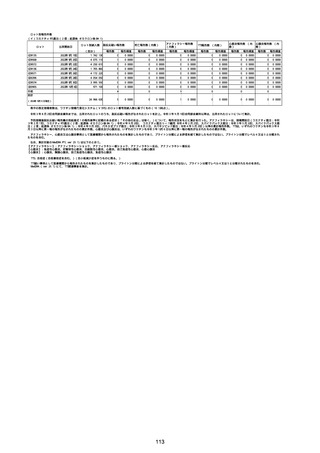
(イ)コミナティRTU筋注(2価:起源株/オミクロン株BA.1)(4回目接種)
一般・全身障害および投与部位の状態
歩行不能
筋骨格系および結合組織障害
筋力低下
心臓障害
徐脈
神経系障害
意識変容状態
眼振
失神寸前の状態
脳梗塞
浮動性めまい
痙攣発作
精神障害
幻視
不快気分
臨床検査
血圧低下
心拍数減少
総計
1
1
1
1
1
1
1
1
1
1
1
1
1
13
※接種開始日(コミナティ筋注:令和3年2月17日、コミナティRTU筋注(2価:起源株/オミ
クロン株BA.1):令和4年9月20日、 コミナティ筋注5〜11歳用:令和4年2月21日、スパイ
クバックス筋注:令和3年5月22日、スパイクバックス筋注(2価:起源株/オミクロン株
BA.1):令和4年9月20日、バキスゼブリア筋注:令和3年8月3日、ヌバキソビッド筋注:
令和4年5月25日)以降の累計報告件数。
※資料1−2−2−6「3.報告症例一覧(製造販売業者からの報告)」を基に、MedDRA SOC
(太字部)及びPTを元に分類の上集計。
101