資料1-2-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00055.html |
| 出典情報 | 第 88 回厚生科学審議会予防接種・ワクチン分科会 副反応検討部会、令和4年度第 18 回薬事・食品衛生審 議会薬事分科会医薬品等安全対策部会安全対策調査会(11/11)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
販売名:コミナティ筋注
販売名:コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
販売名:コミナティ筋注5〜11歳用
製造販売業者:ファイザー株式会社
製造販売業者:ファイザー株式会社
製造販売業者:ファイザー株式会社
販売開始年月:2021年2月
販売開始年月:2022年9月
販売開始年月:2022年2月
効能・効果:SARS-CoV-2による感染症の予防
効能・効果:SARS-CoV-2による感染症の予防
効能・効果:SARS-CoV-2による感染症の予防
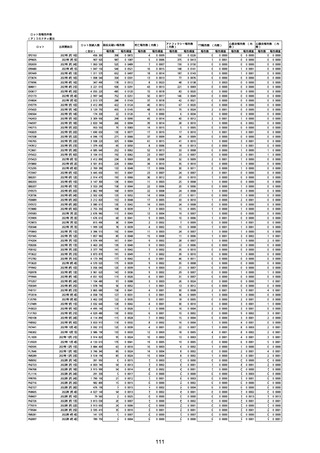
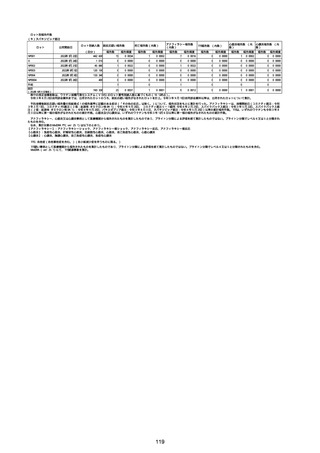
①週別報告件数
コミナティ筋注(総数)
接種日
副反応疑い報告数
推定接種者数
(回分)
報告数
コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
死亡報告数(内数)
報告頻度
報告数
2/17−3/14
230,542
393
0.1705%
3/15−4/11
1,361,975
1,532
4/12−5/9
3,068,570
2,108
5/10−6/6
12,363,954
6/7−7/4
推定接種者数
報告頻度
(回分)
副反応疑い報告数
報告数
コミナティ筋注5〜11歳用
死亡報告数(内数)
報告頻度
報告数
副反応疑い報告数
推定接種者数
報告頻度
(回分)
報告数
死亡報告数(内数)
報告頻度
報告数
報告頻度
2
0.0009%
0.1125%
9
0.0007%
0.0687%
56
0.0018%
3,486
0.0282%
338
0.0027%
30,792,152
3,188
0.0104%
464
0.0015%
7/5−8/1
34,656,408
2,140
0.0062%
242
0.0007%
8/2−8/29
26,176,377
1,335
0.0051%
79
0.0003%
8/30−9/26
26,321,054
1,236
0.0047%
48
0.0002%
9/27−10/24
20,483,641
809
0.0039%
36
0.0002%
10/25−11/21
8,800,834
319
0.0036%
17
0.0002%
11/22−12/19
2,310,881
199
0.0086%
8
0.0003%
12/20−22/1/16
3,144,196
165
0.0052%
3
0.0001%
22/1/17−2/13
8,897,470
343
0.0039%
53
0.0006%
2/14−3/13
14,516,533
388
0.0027%
72
0.0005%
81,373
11
0.0135%
0
0.0000%
3/14−4/10
10,009,453
172
0.0017%
18
0.0002%
834,613
41
0.0049%
0
0.0000%
4/11−5/8
6,745,088
147
0.0022%
7
0.0001%
911,669
36
0.0039%
1
0.0001%
5/9−6/5
4,760,481
100
0.0021%
6
0.0001%
551,477
19
0.0034%
0
0.0000%
6/6−7/3
2,895,208
60
0.0021%
10
0.0003%
270,175
6
0.0022%
0
0.0000%
7/4−7/31
8,676,394
99
0.0011%
20
0.0002%
177,441
4
0.0023%
0
0.0000%
8/1−8/28
9,707,959
84
0.0009%
8
0.0001%
213,917
4
0.0019%
0
0.0000%
8/29−9/25
5,446,310
28
0.0005%
5
0.0001%
29,863
1
0.0033%
0
0.0000%
159,324
2
0.0013%
1
0.0006%
9/26−10/2
980,313
4
0.0004%
0
0.0000%
341,656
2
0.0006%
0
0.0000%
57,736
1
0.0017%
0
0.0000%
10/3−10/9
958,383
0
0.0000%
0
0.0000%
709,837
0
0.0000%
0
0.0000%
57,402
0
0.0000%
0
0.0000%
-
2,754
-
108
-
2
-
0
-
-
22
-
0
-
243,304,176
21,089
0.0087%
1,609
0.0007%
5
0.0005%
0
0.0000%
3,315,127
146
0.0044%
2
0.0001%
不明
合計
1,081,356
(2022年10月9日現在)
※製造販売業者からの報告は、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第68条の10第1項に基づき、「重篤」と判断された症例について報告されたものである。なお、製造販売業者からの報告には、医
療機関から報告された症例と重複している症例が含まれている。当該分類は、製造販売業者の評価に基づくものであり、PMDAが個別に医薬品との関連性を評価したものではない。
※「重篤」とは、①死亡、②障害、③それらに繋がるおそれのあるもの、④入院、⑤①〜④に準じて重いもの、⑥後世代における先天性の疾病又は異常のものとされているが、必ずしも重篤でない事象も「重篤」として報告される
ケースがある。
※報告された後、その後の調査等によって、報告対象でないことが確認され、報告が取り下げられた場合は、遡って各々の件数から当該症例を除いている。
※製造販売業者からの報告には、複数の製造販売業者から重複して報告されている症例が含まれている可能性がある。
※推定接種回数(首相官邸Webサイト(10/12時点掲載データ参照))
○コミナティ
:
242,222,820回(1回目 86,097,254回、2回目 85,018,192回、3回目 48,954,023回、4回目 22,153,351回)
〇コミナティRTU(2価:起源株/オミクロン株BA.1)
:
1,081,356回(1回目
0回、2回目
0回、3回目
92,868回、4回目
988,488回)
○コミナティ5〜11歳用
:
3,315,127回(1回目 1,647,011回、2回目 1,573,089回、3回目
95,027回)
○スパイクバックス
:
78,774,834回(1回目 16,400,323回、2回目 16,198,844回、3回目 33,290,193回、4回目 12,885,474回)
〇スパイクバックス(2価:起源株/オミクロン株BA.1)
:
166,803回(1回目
0回、2回目
0回、3回目
13,898回、4回目
152,905回)
〇バキスゼブリア
:
117,838回(1回目
58,694回、2回目
59,144回)
〇ヌバキソビッド
:
220,465回(1回目
35,904回、2回目
31,026回、3回目
153,535回)
なお、表中の推定接種者数が0(回分)であっても、必ずしも当該週に接種が行われていないことを意味しない。
※報告数は、直近日曜日時点での情報により予防接種との因果関係が不明な事象も含めている。よって、詳細な情報が得られたことによって予防接種との因果関係が否定された事象は、表から除外され各件数が変わることがある。
※報告数は副反応疑い報告の件数を集計したもの。1症例(1患者)で複数件の副反応疑い報告が提出される場合があるため、報告数と症例数(患者数)は一致しない。
※同一の副反応疑い事例であっても、報告内容(転帰等)の更新等により複数回報告される場合がある。同一副反応疑い事例が複数回報告された場合は、集計時点で最後に報告された報告内容に基づき集計している。
※接種回数は製造販売業者の調査に基づく。1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計してい
る。
※上記の注は、以下の表でも同様。
3