よむ、つかう、まなぶ。
17【参考資料2-5】沈降精製百日せきジフテリア破傷風混合ワクチン(DTaP)(第15回ワクチン評価に関する小委員会資料1) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29181.html |
| 出典情報 | 厚生科学審議会予防接種・ワクチン分科会(第41回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
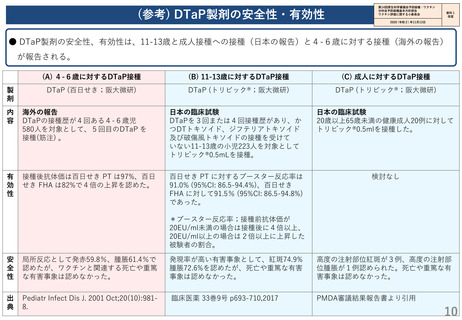
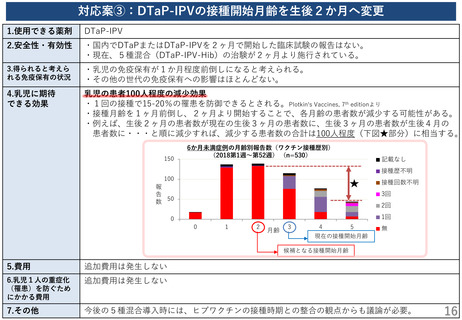
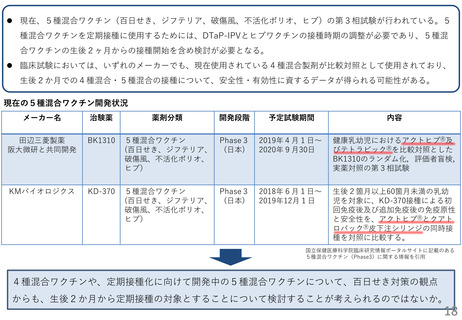
(参考) DTaP製剤の安全性・有効性
第14回厚生科学審議会予防接種・ワクチン
分科会予防接種基本方針部会
ワクチン評価に関する小委員会
資料1
改変
2020 (令和2) 年11月13日
● DTaP製剤の安全性、有効性は、11-13歳と成人接種への接種(日本の報告)と4-6歳に対する接種(海外の報告)
が報告される。
製
剤
(A) 4-6歳に対するDTaP接種
(B) 11-13歳に対するDTaP接種
(C) 成人に対するDTaP接種
DTaP (百日せき;阪大微研)
DTaP (トリビック®;阪大微研)
DTaP (トリビック®;阪大微研)
内
容
海外の報告
DTaPの接種歴が4回ある4-6歳児
580人を対象として、5回目のDTaP を
接種(筋注) 。
日本の臨床試験
DTaPを3回または4回接種歴があり、か
つDTトキソイド、ジフテリアトキソイド
及び破傷風トキソイドの接種を受けて
いない11-13歳の小児223人を対象として
トリビック®0.5mLを接種。
日本の臨床試験
20歳以上65歳未満の健康成人20例に対して
トリビック®0.5mlを接種した。
有
効
性
接種後抗体価は百日せき PT は97%、百日
せき FHA は82%で4倍の上昇を認めた。
百日せき PT に対するブースター反応率は
91.0% (95%CI: 86.5-94.4%)、百日せき
FHA に対して91.5% (95%CI: 86.5-94.8%)
であった。
検討なし
*ブースター反応率;接種前抗体価が
20EU/ml未満の場合は接種後に4倍以上、
20EU/ml以上の場合は2倍以上に上昇した
被験者の割合。
安
全
性
局所反応として発赤59.8%、腫脹61.4%で
認めたが、ワクチンと関連する死亡や重篤
な有害事象は認めなかった。
発現率が高い有害事象として、紅斑74.9%
腫脹72.6%を認めたが、死亡や重篤な有害
事象は認めなかった。
高度の注射部位紅斑が3例、高度の注射部
位腫脹が1例認められた。死亡や重篤な有
害事象は認めなかった。
出
典
Pediatr Infect Dis J. 2001 Oct;20(10):9818.
臨床医薬 33巻9号 p693-710,2017
PMDA審議結果報告書より引用
10
第14回厚生科学審議会予防接種・ワクチン
分科会予防接種基本方針部会
ワクチン評価に関する小委員会
資料1
改変
2020 (令和2) 年11月13日
● DTaP製剤の安全性、有効性は、11-13歳と成人接種への接種(日本の報告)と4-6歳に対する接種(海外の報告)
が報告される。
製
剤
(A) 4-6歳に対するDTaP接種
(B) 11-13歳に対するDTaP接種
(C) 成人に対するDTaP接種
DTaP (百日せき;阪大微研)
DTaP (トリビック®;阪大微研)
DTaP (トリビック®;阪大微研)
内
容
海外の報告
DTaPの接種歴が4回ある4-6歳児
580人を対象として、5回目のDTaP を
接種(筋注) 。
日本の臨床試験
DTaPを3回または4回接種歴があり、か
つDTトキソイド、ジフテリアトキソイド
及び破傷風トキソイドの接種を受けて
いない11-13歳の小児223人を対象として
トリビック®0.5mLを接種。
日本の臨床試験
20歳以上65歳未満の健康成人20例に対して
トリビック®0.5mlを接種した。
有
効
性
接種後抗体価は百日せき PT は97%、百日
せき FHA は82%で4倍の上昇を認めた。
百日せき PT に対するブースター反応率は
91.0% (95%CI: 86.5-94.4%)、百日せき
FHA に対して91.5% (95%CI: 86.5-94.8%)
であった。
検討なし
*ブースター反応率;接種前抗体価が
20EU/ml未満の場合は接種後に4倍以上、
20EU/ml以上の場合は2倍以上に上昇した
被験者の割合。
安
全
性
局所反応として発赤59.8%、腫脹61.4%で
認めたが、ワクチンと関連する死亡や重篤
な有害事象は認めなかった。
発現率が高い有害事象として、紅斑74.9%
腫脹72.6%を認めたが、死亡や重篤な有害
事象は認めなかった。
高度の注射部位紅斑が3例、高度の注射部
位腫脹が1例認められた。死亡や重篤な有
害事象は認めなかった。
出
典
Pediatr Infect Dis J. 2001 Oct;20(10):9818.
臨床医薬 33巻9号 p693-710,2017
PMDA審議結果報告書より引用
10