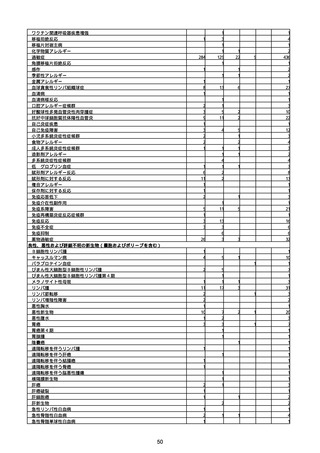
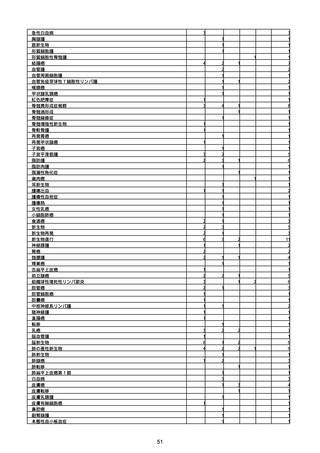
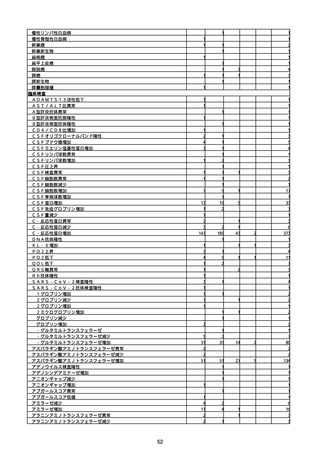
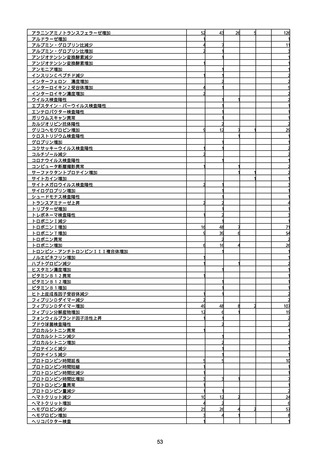
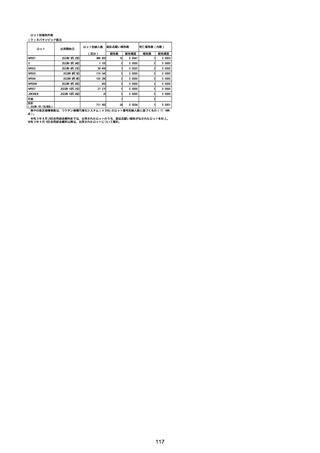
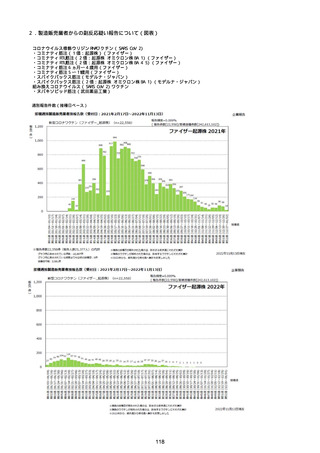
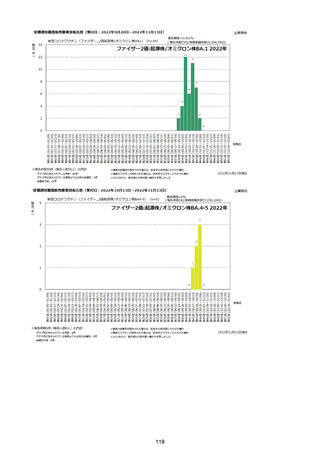
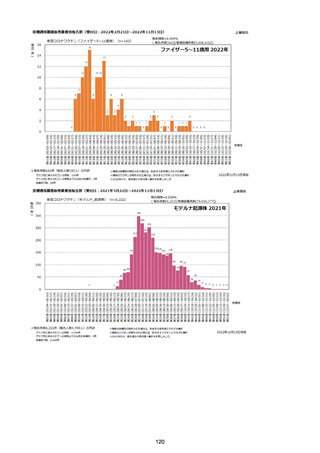
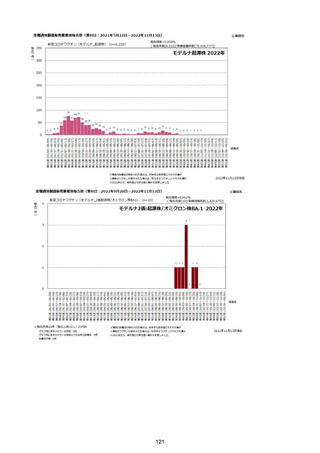
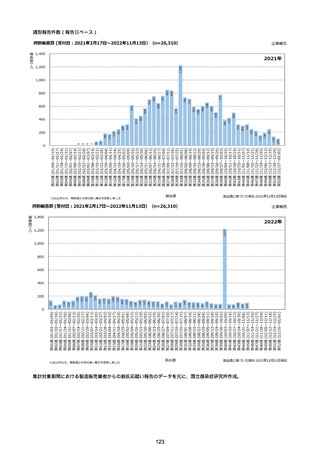
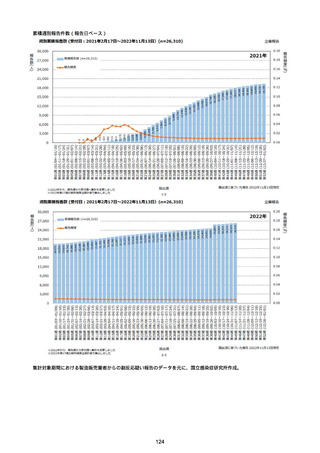
資料1-2-1 薬機法に基づく製造販売業者からの副反応疑い報告状況について (94 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00056.html |
| 出典情報 | 第89回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第21回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(12/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
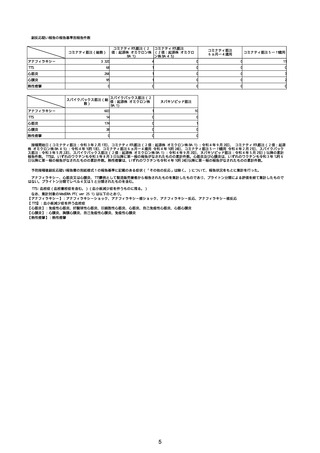
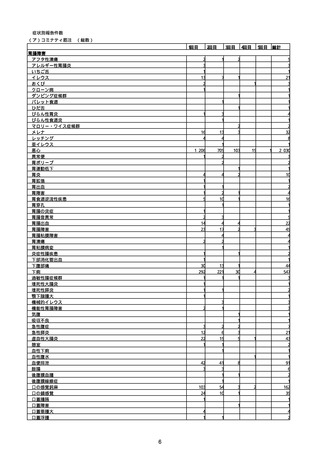
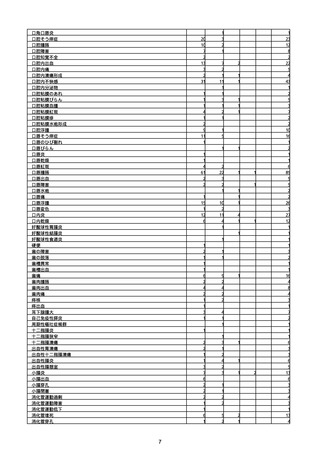
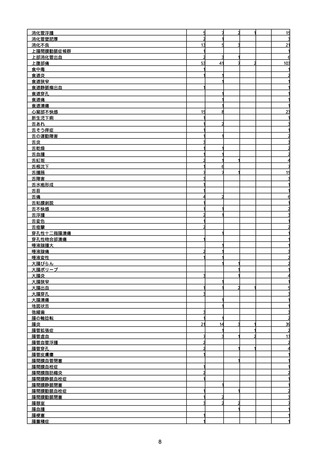
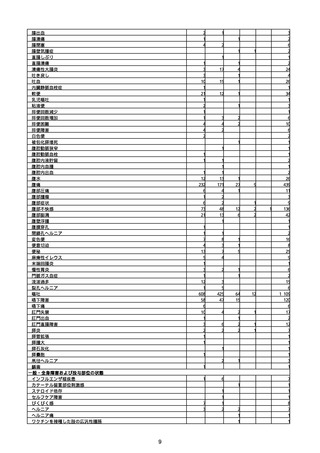
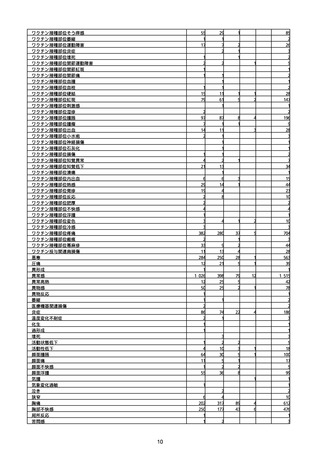
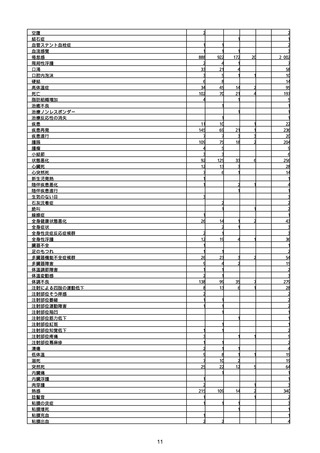
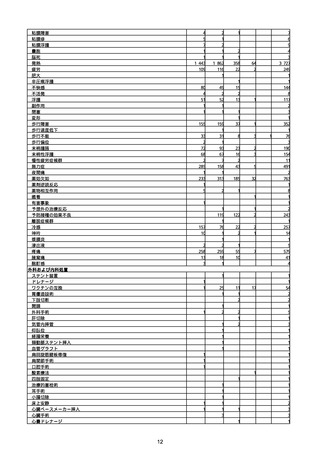
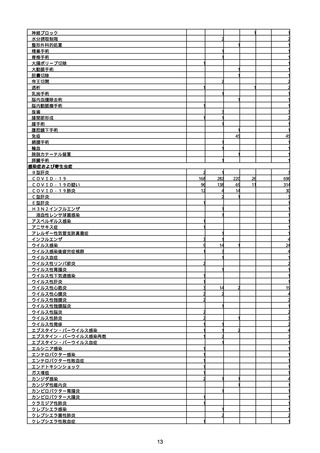
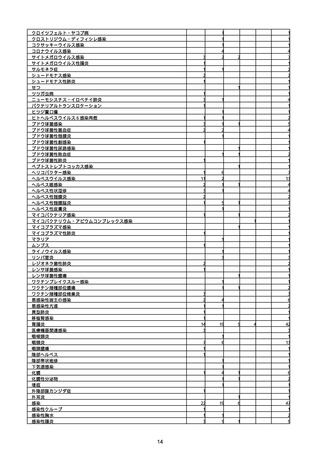
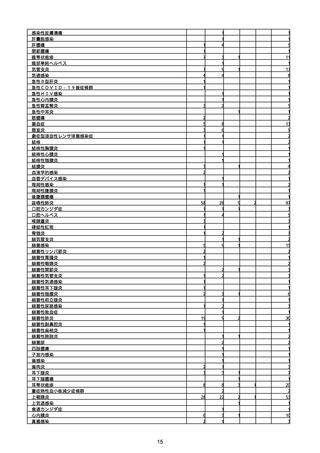
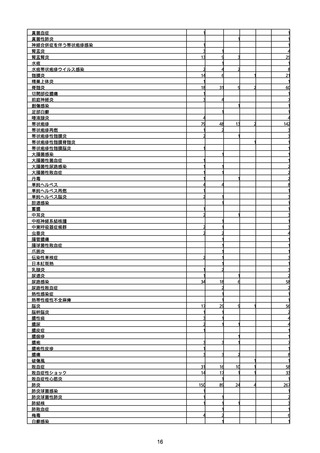
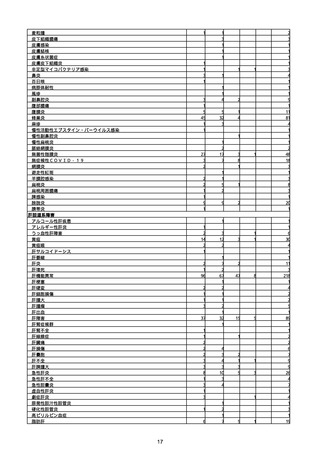
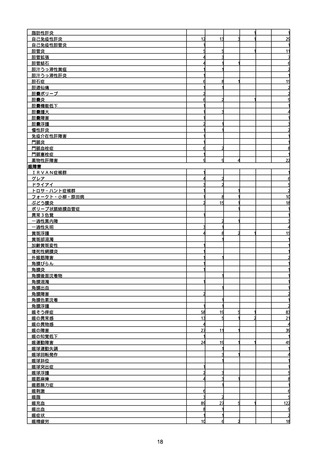
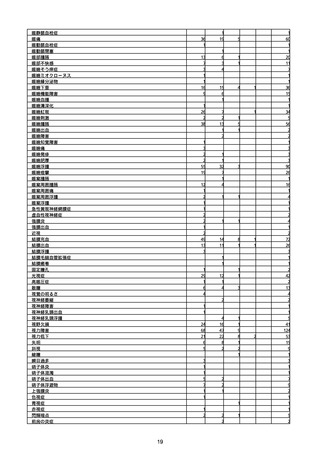
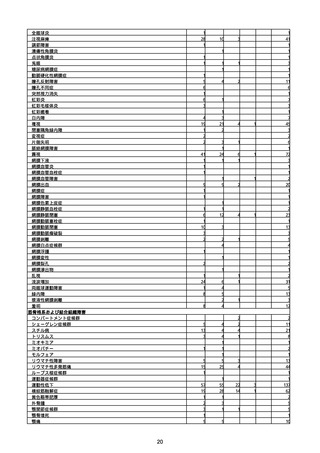
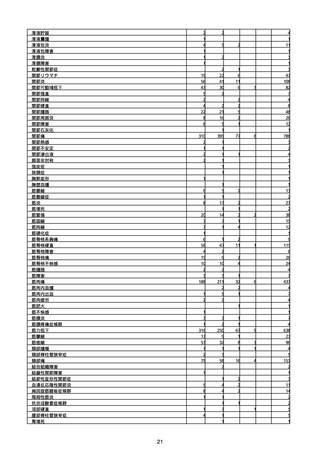
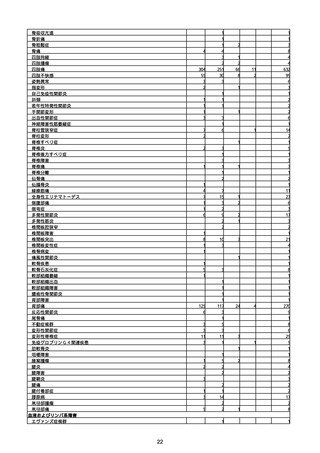
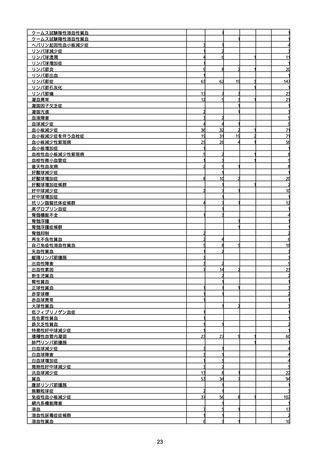
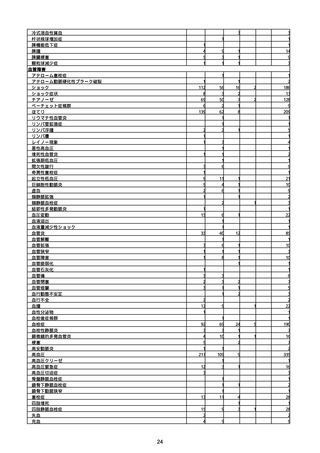
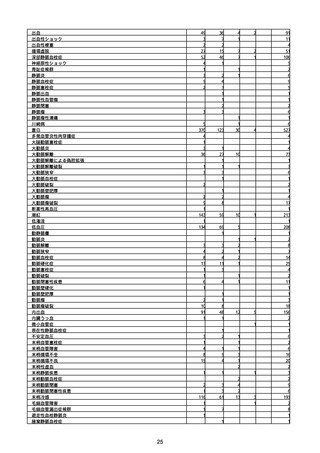
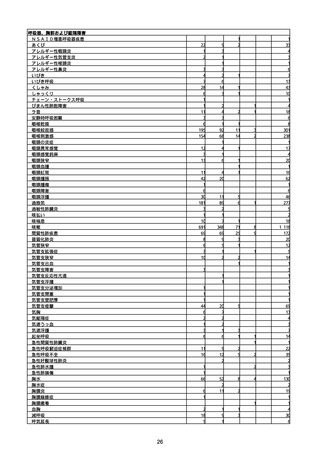
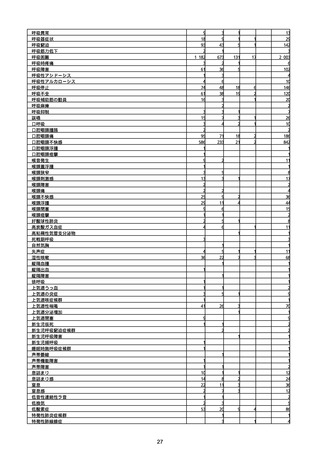
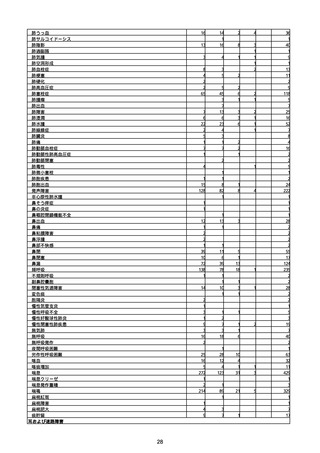
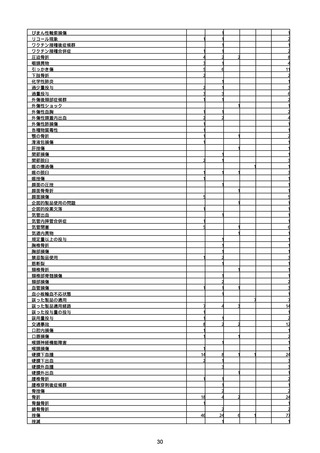
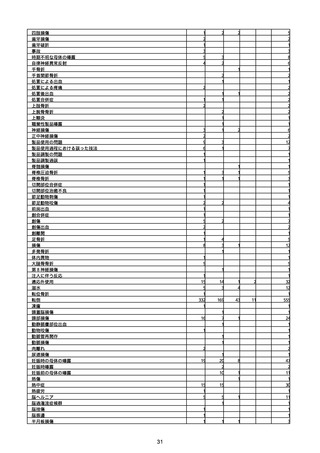
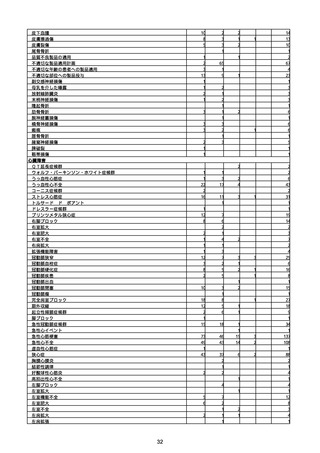
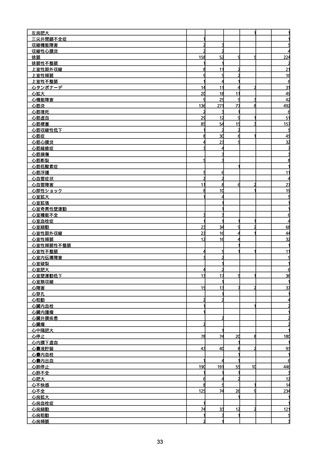
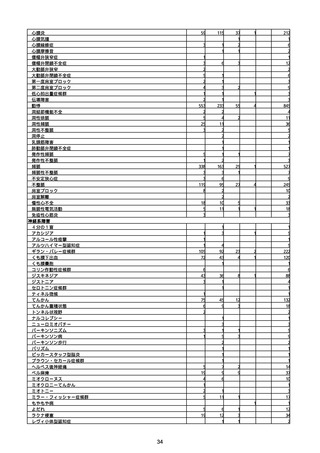
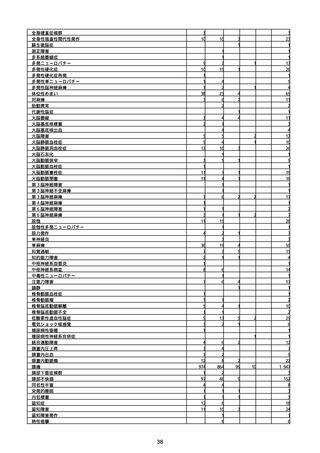
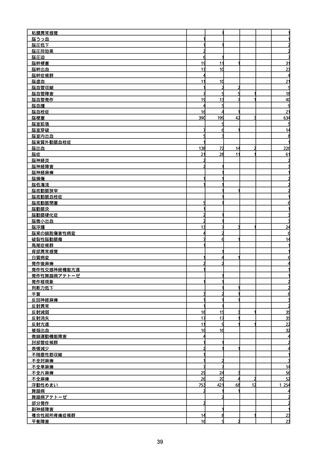
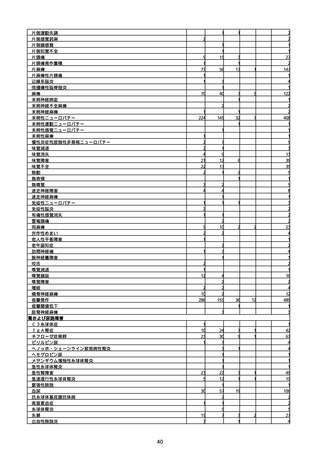
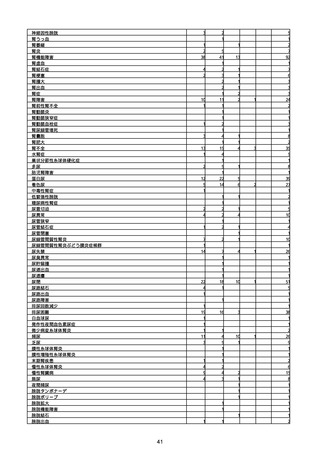
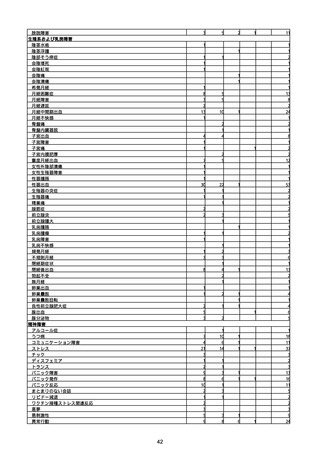
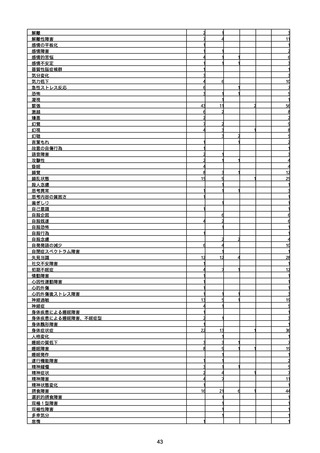
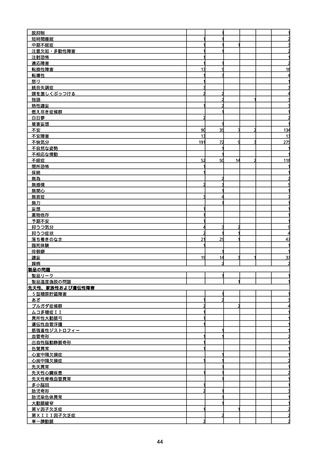
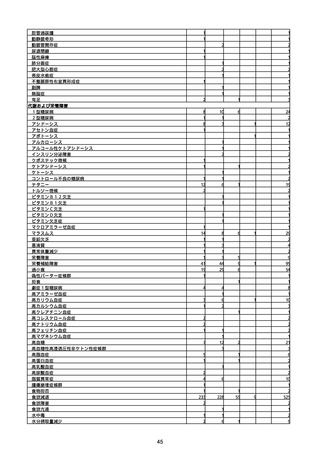
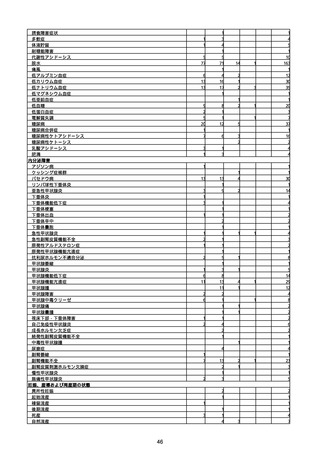
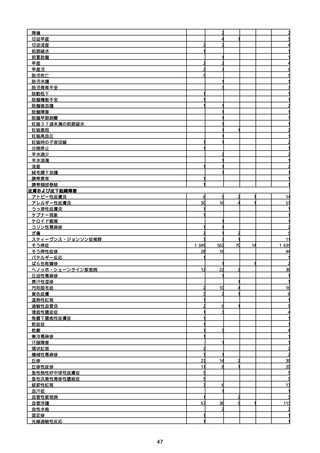
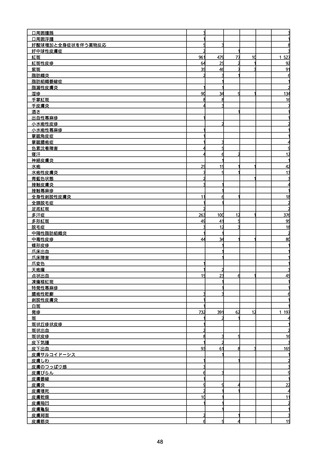
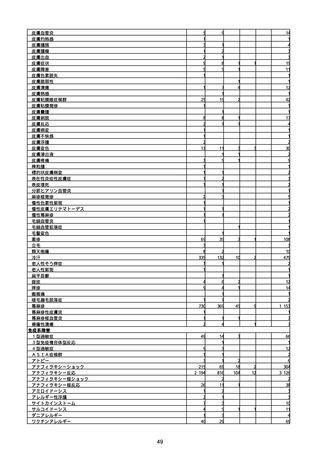
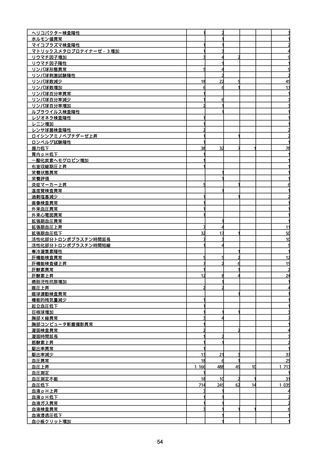
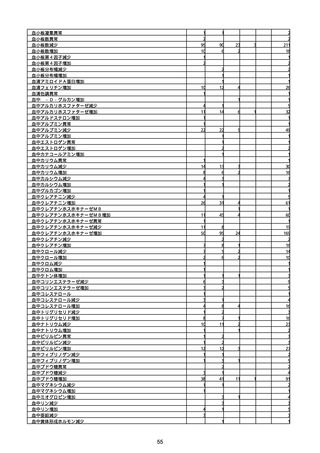
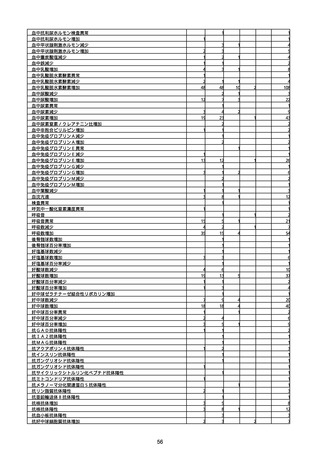
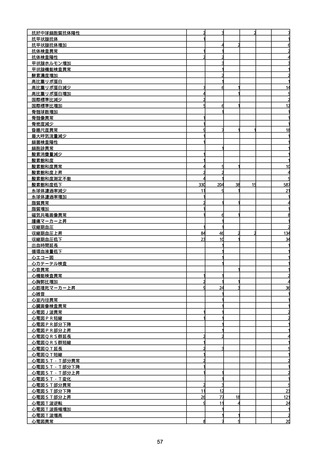
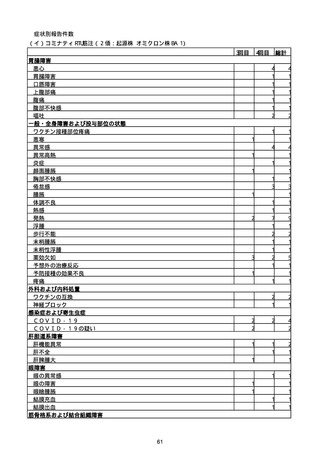
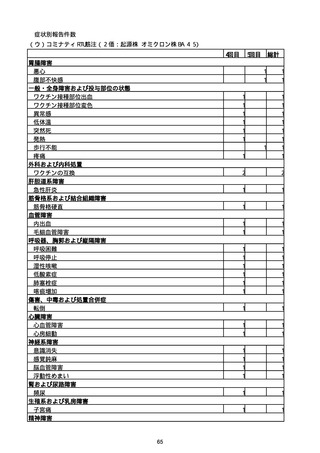
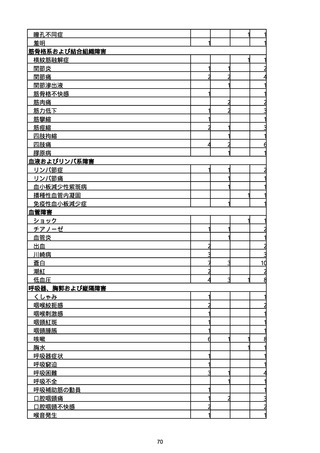
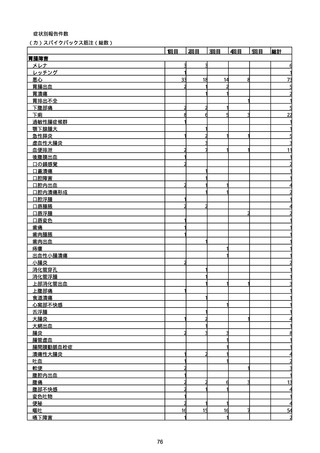
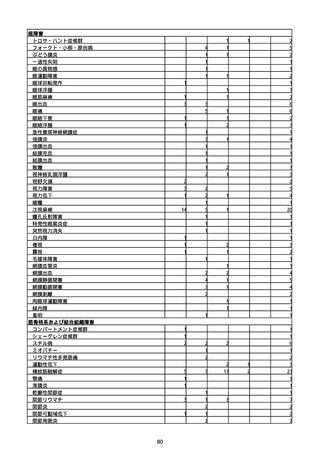
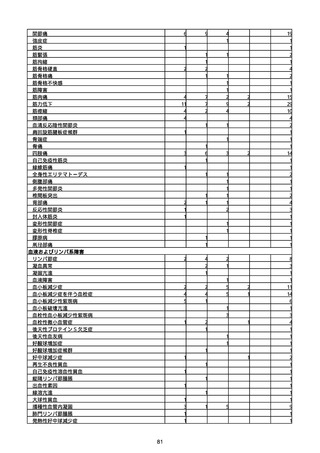
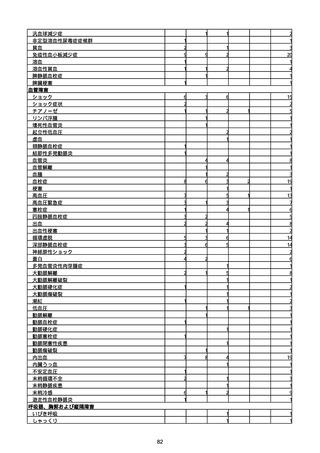
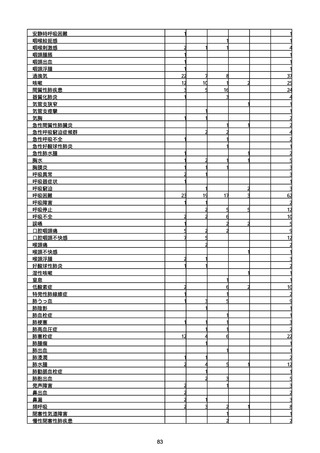
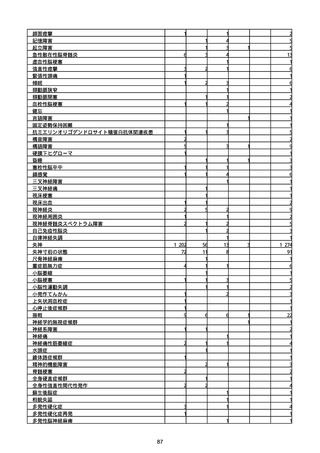
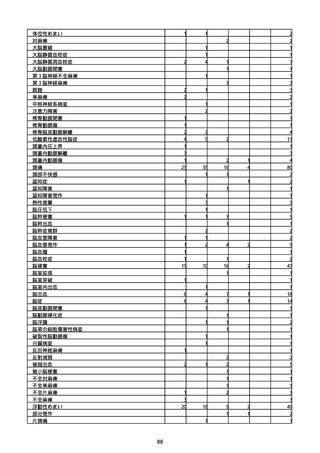
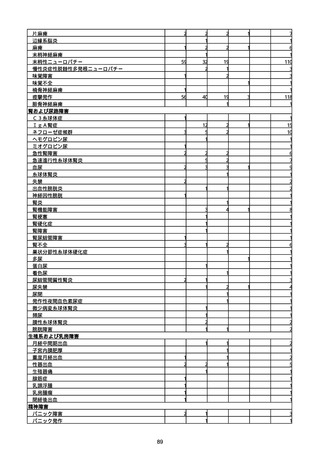
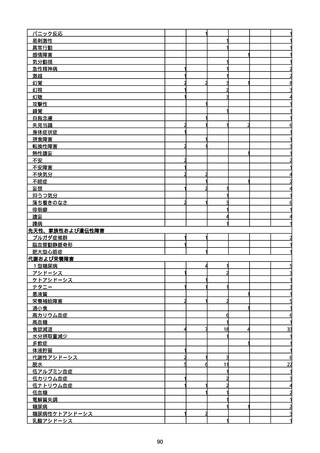
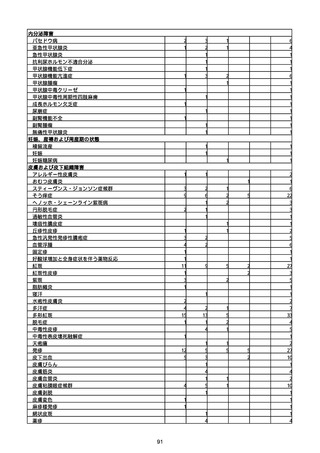
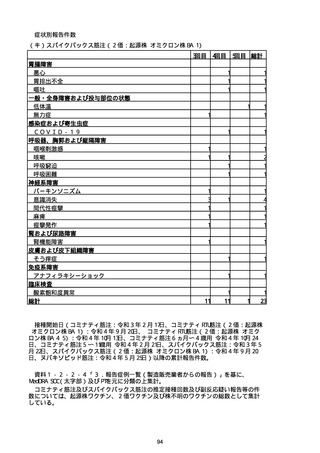
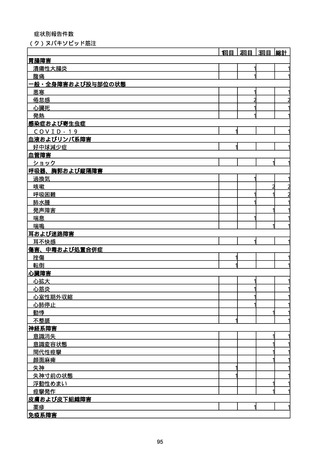
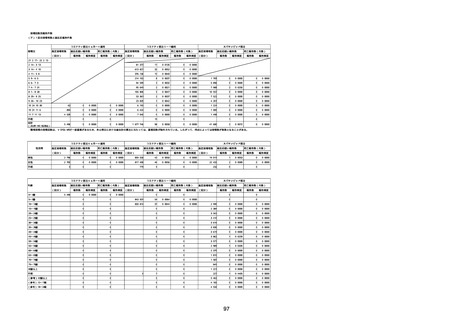
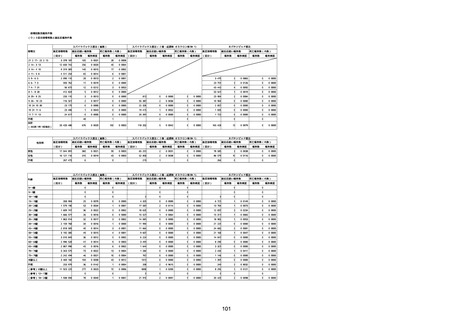
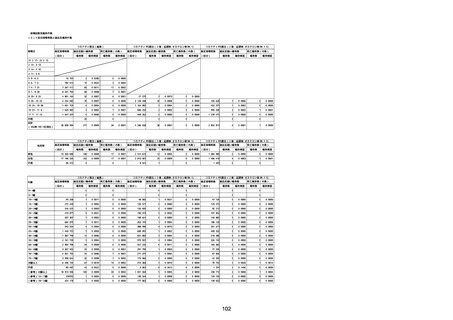
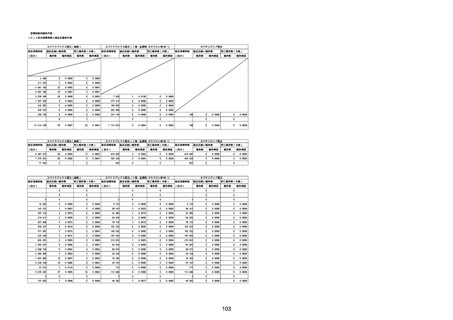
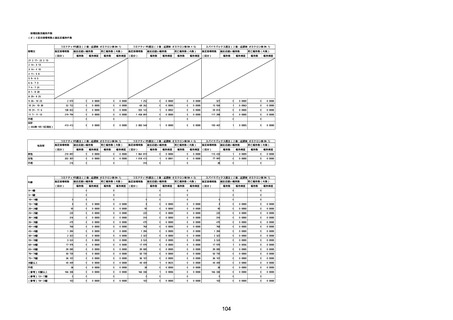
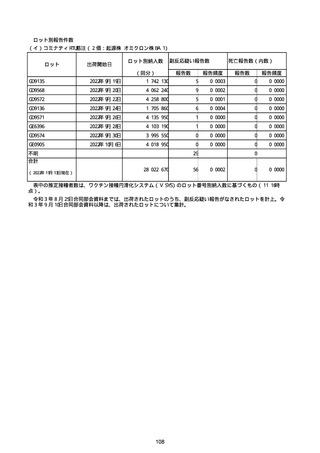
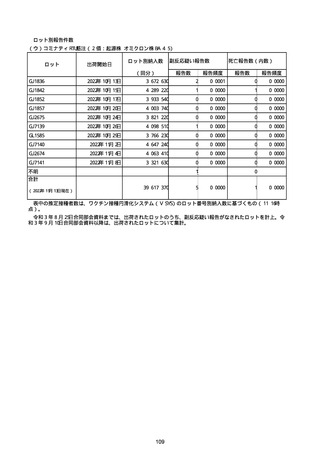
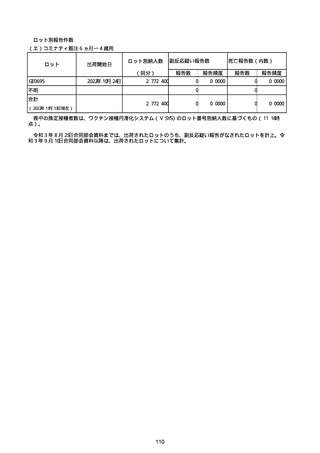
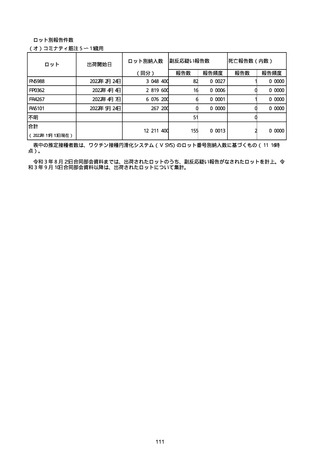
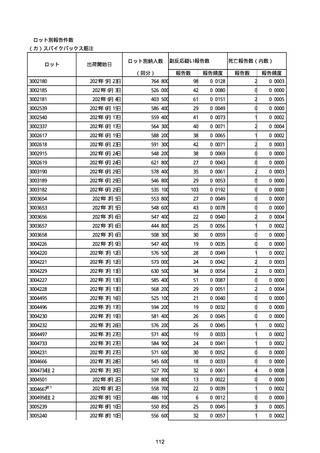
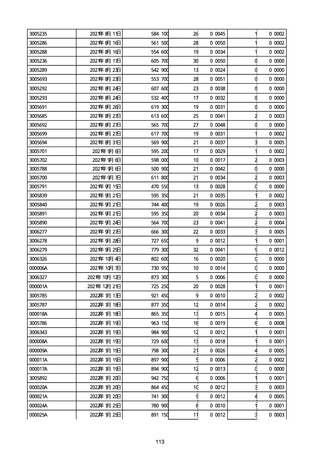
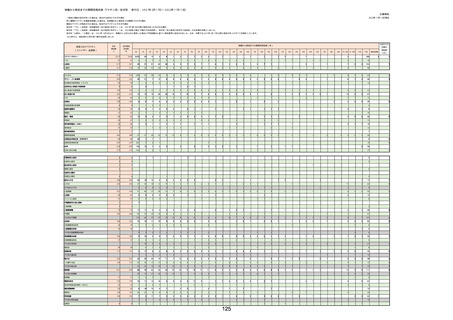
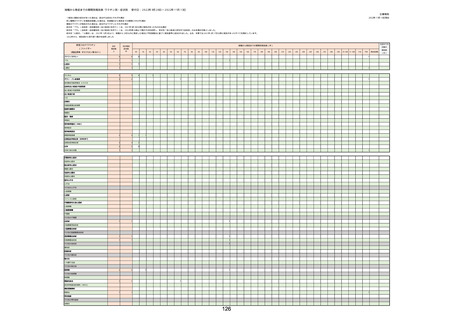
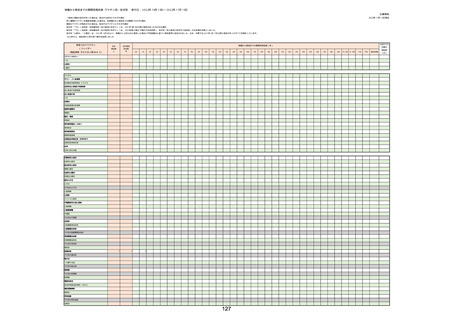
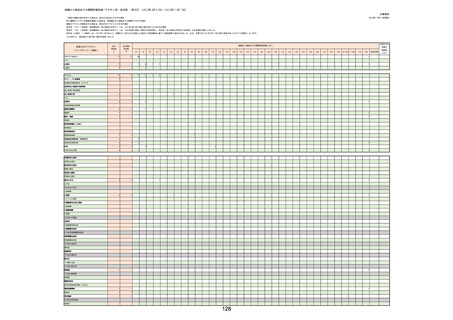
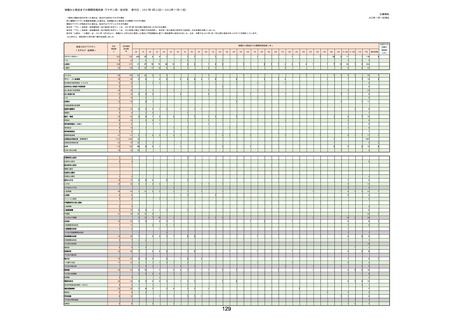
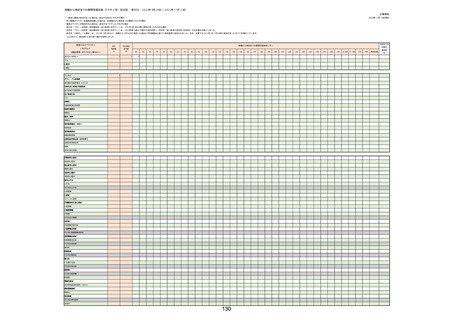
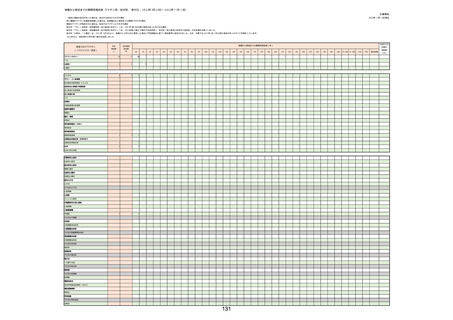
(キ)スパイクバックス筋注(2価:起源株/オミクロン株BA.1)
3回目 4回目 5回目 総計
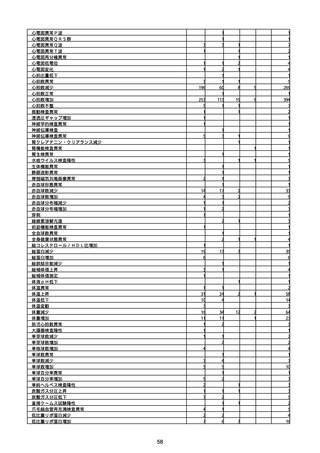
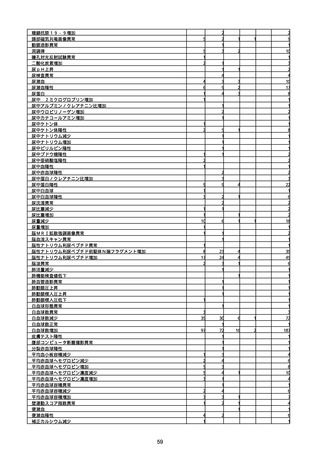
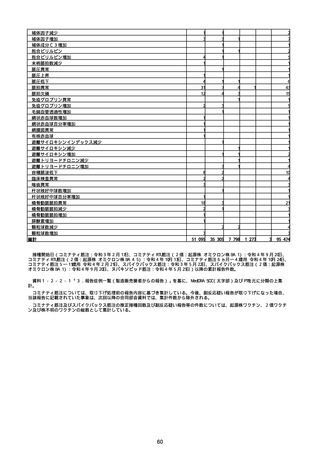
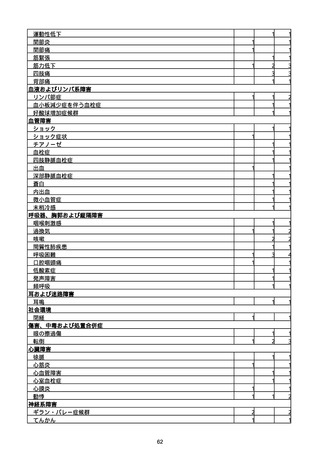
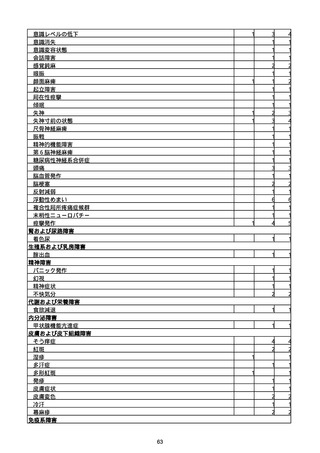
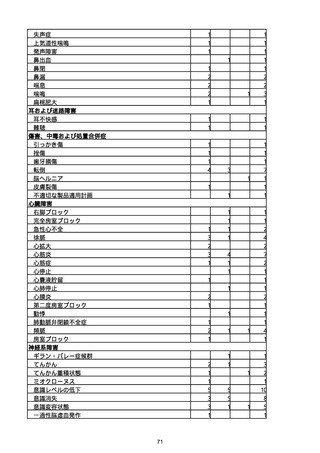
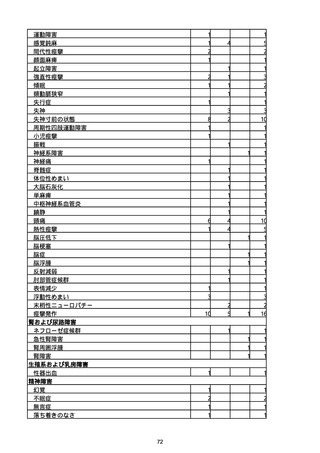
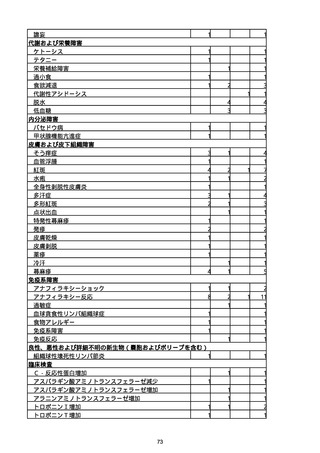
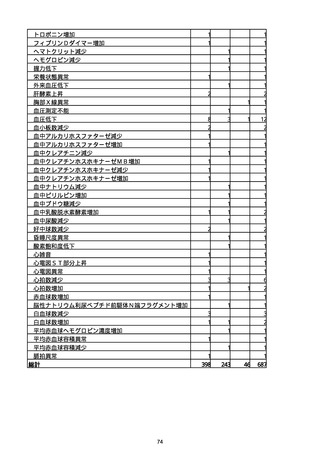
胃腸障害
悪心
胃排出不全
嘔吐
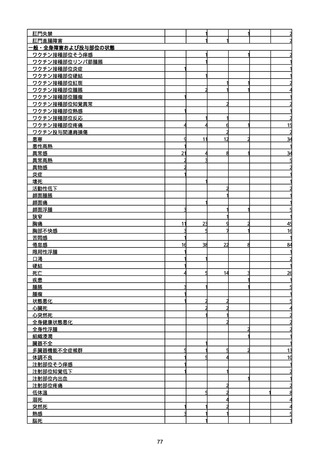
一般・全身障害および投与部位の状態
低体温
無力症
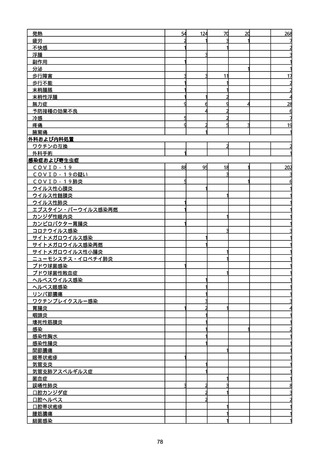
感染症および寄生虫症
COVID−19
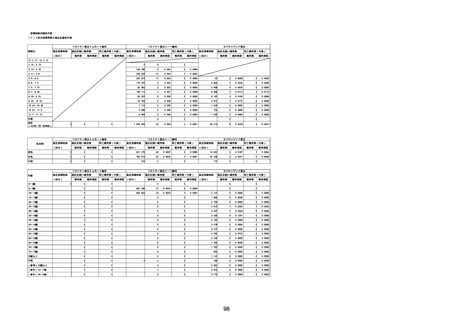
呼吸器、胸郭および縦隔障害
咽喉刺激感
咳嗽
呼吸窮迫
呼吸困難
神経系障害
パーキンソニズム
意識消失
間代性痙攣
麻痺
痙攣発作
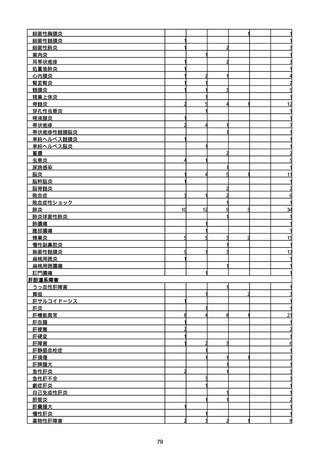
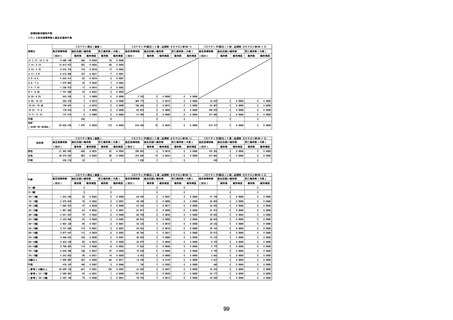
腎および尿路障害
腎機能障害
皮膚および皮下組織障害
そう痒症
免疫系障害
アナフィラキシーショック
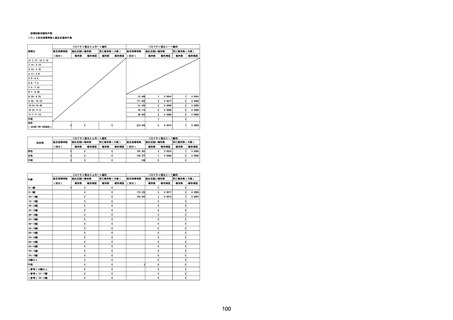
臨床検査
酸素飽和度異常
総計
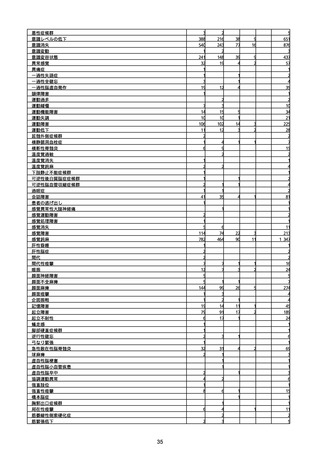
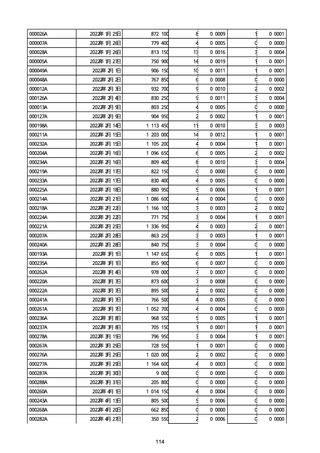
1
1
1
1
1
1
1
1
1
1
1
1
1
3
1
1
1
1
1
1
1
1
1
2
1
1
1
4
1
1
1
1
1
11
1
1
1
1
1
1
11
1
23
1
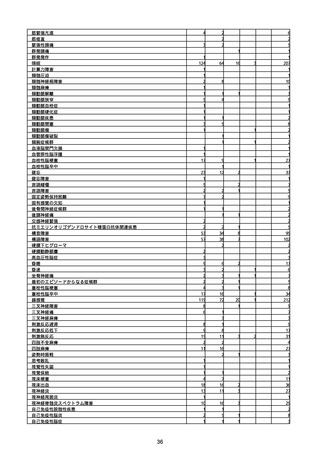
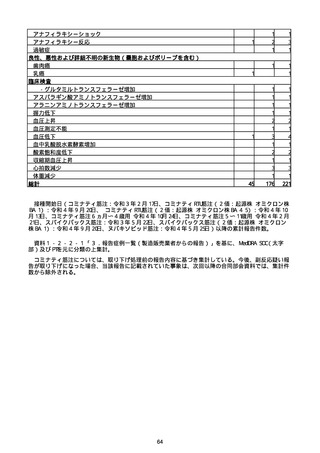
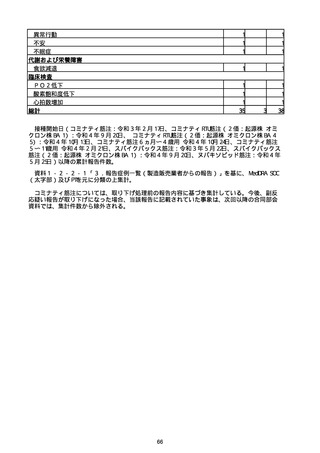
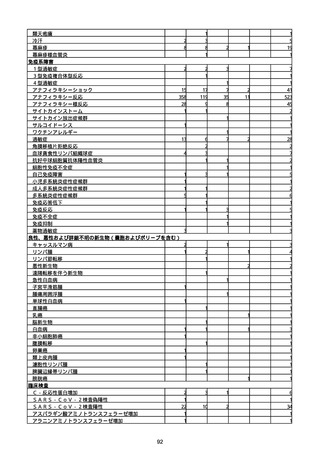
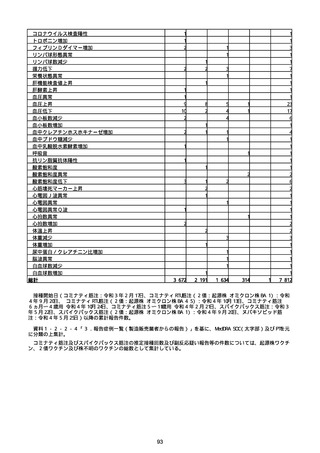
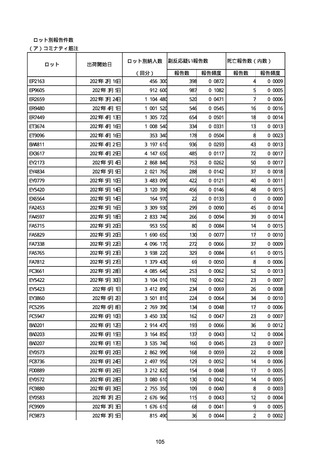
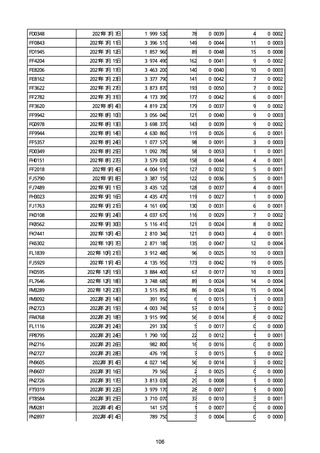
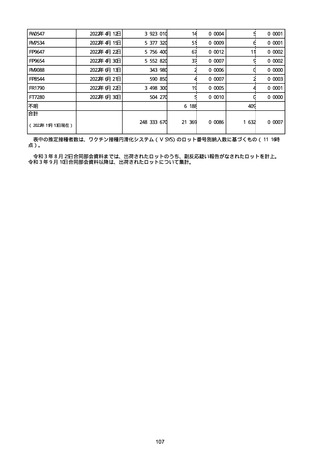
※接種開始日(コミナティ筋注:令和3年2月17日、コミナティRTU筋注(2価:起源株
/オミクロン株BA.1):令和4年9月20日、 コミナティRTU筋注(2価:起源株/オミク
ロン株BA.4-5):令和4年10月13日、コミナティ筋注6ヵ月〜4歳用:令和4年10月24
日、コミナティ筋注5〜11歳用:令和4年2月21日、スパイクバックス筋注:令和3年5
月22日、スパイクバックス筋注(2価:起源株/オミクロン株BA.1):令和4年9月20
日、ヌバキソビッド筋注:令和4年5月25日)以降の累計報告件数。
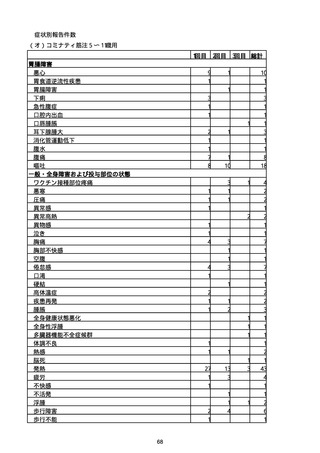
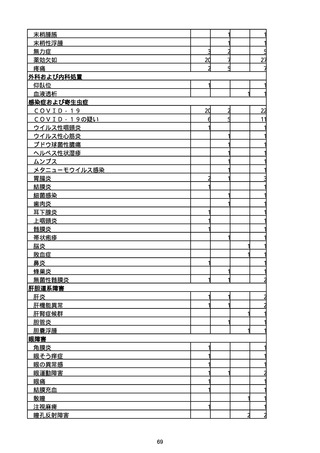
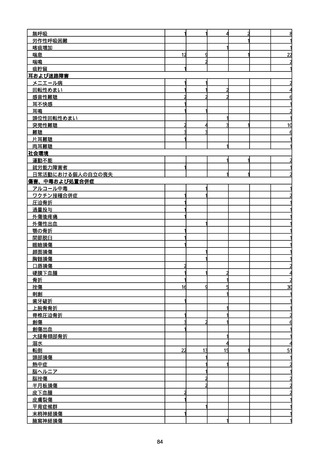
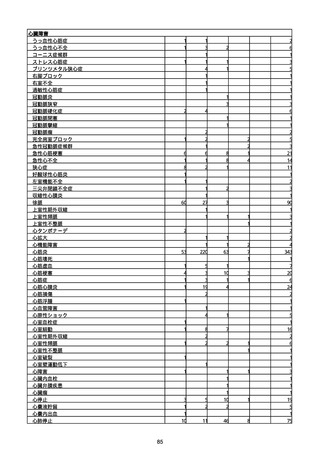
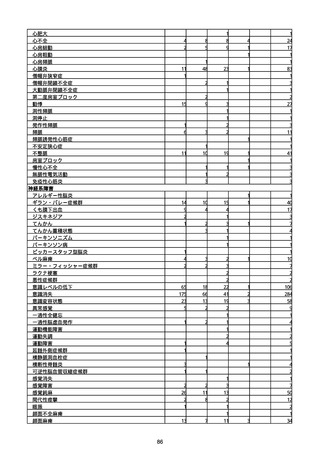
※資料1−2−2−4「3.報告症例一覧(製造販売業者からの報告)」を基に、
MedDRA SOC(太字部)及びPTを元に分類の上集計。
※コミナティ筋注及びスパイクバックス筋注の推定接種回数及び副反応疑い報告等の件
数については、起源株ワクチン、2価ワクチン及び株不明のワクチンの総数として集計
している。
94