よむ、つかう、まなぶ。
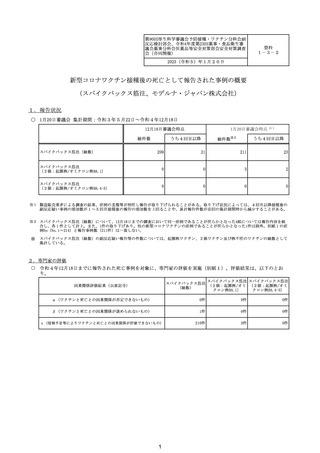
資料1-3-2 新型コロナワクチン接種後の死亡として報告された事例の概要(スパイクバックス筋注) (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/vaccine_hukuhannou-utagai-houkoku.html |
| 出典情報 | 第90回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第23回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(1/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
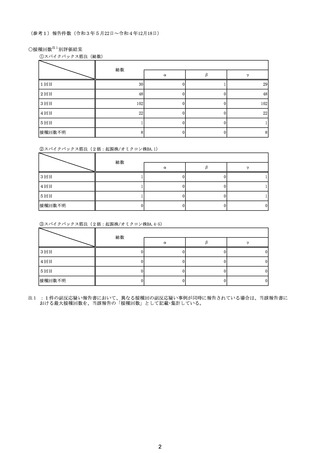
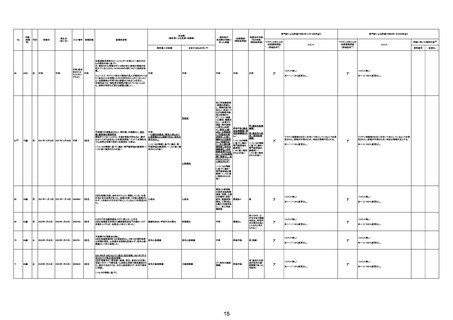
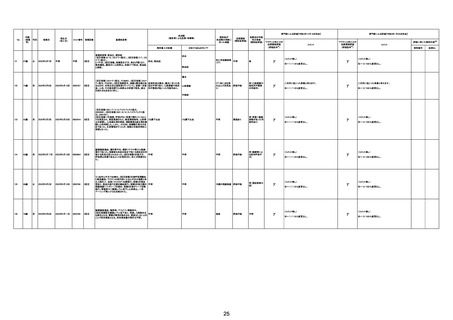
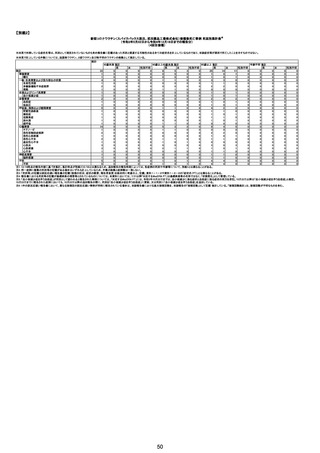
No
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
死因等
(報告者による見解・考察等)
基礎疾患等
報告書上の記載
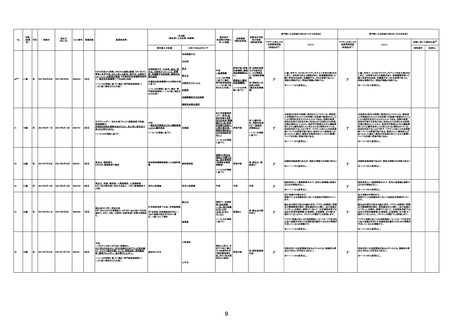
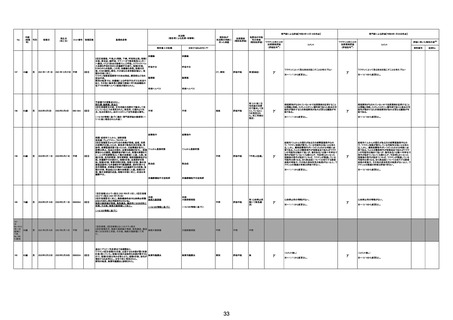
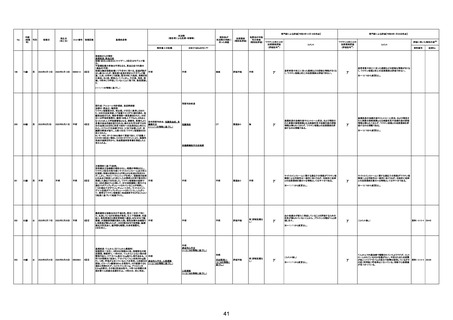
210
※
No.102と
同一の
症例に
つき、
No.102
に統合
211
212
20代
24歳
(~1/20
女
の情報
に基づ
く。)
84歳
男
不明
2022年8月22日
2022年8月27日
000317A
70歳
男
2022年3月6日
2022年3月7日
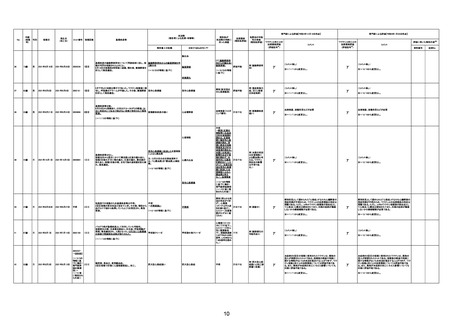
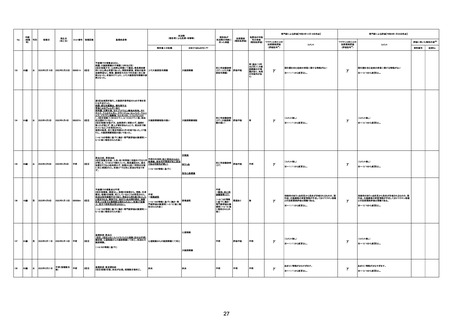
213
※No.23
と同一
の症例 30歳
につき、
No.23に
統合
男
不明
不明(接種3日後) 不明
214
70歳
男
2022年8月28日
2022年8月30日
000026A
000261A
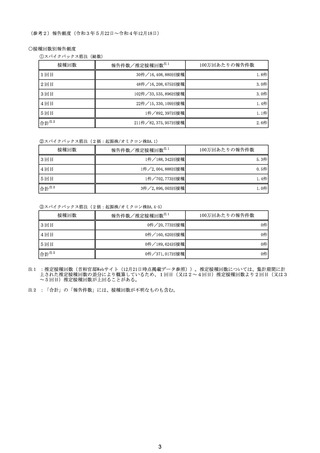
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
3回目
原疾患等:軽度精神遅滞
5日間の進行性の食欲不振、呼吸困難、見当識障害が
あった。患者の上肢に点状出血および紫斑が発現した。
本剤接種後17日後に、入院した。病院到着後、患者の 血栓性血小板減少性紫斑病
意識と呼吸不全は急速に悪化した。コルチコステロイド
療法を受けたが、心肺停止に陥り、入院から 6 時間後に
死亡。
血栓性血小板減少性紫斑病
不明
4回目
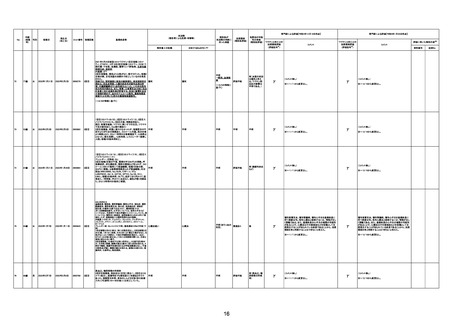
基礎疾患:アルツハイマー型認知症、不安焦燥型うつ
病、糖尿病、糖尿病性腎症、糖尿病性網膜症、脳梗塞
後遺症、慢性心不全
精神的に落ち着かず、ワクチン接種の約2ヶ月前に精神
病棟に入院。症状やや軽快傾向で内科病棟で退院先と
なる特養への退院準備のためのリハビリを開始している
不明
状態だった。退院前のワクチン接種を希望され、ワクチ
ンを接種。翌日から食欲低下が見られ食事量がやや減
少していたため、補液を行っていた。ワクチン接種 5日
後の16時、16時半訪室時には普通の会話をしていた
が、16:55訪室時、血液低下、心拍60に低下。その後、
すぐに心停止となり死亡。
不明
不明
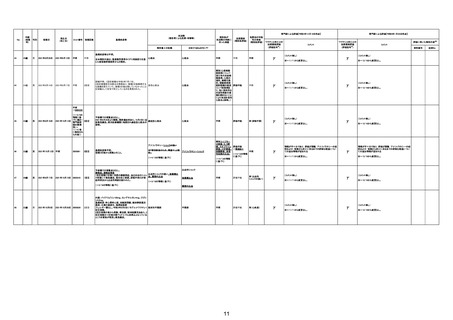
3回目
接種翌日心肺停止で搬送。胃静脈瘤破裂による死亡疑
胃静脈瘤破裂
い。
胃静脈瘤破裂
不明
評価不能
不明
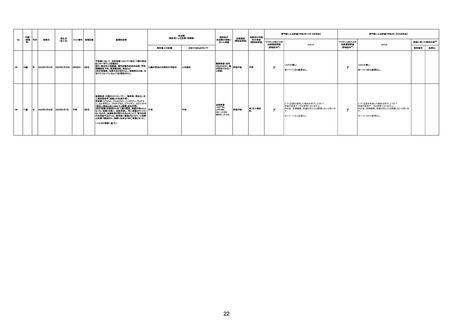
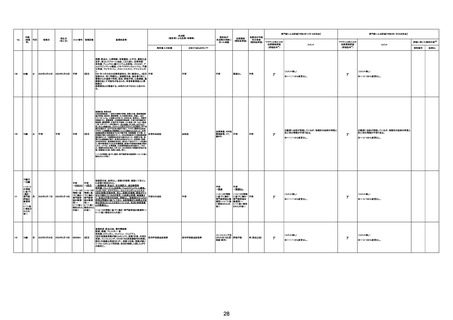
2回目
2回目の投与を受けた。発熱を発現。仕事を休んで翌日
も休んでいた。夕方に帰宅し、通常通りに夕食を摂取し、
不明
自室に向かった。3日後患者は目覚めず、家族が行った
時に死亡しているのが発見された。
不明
剖検
不明
不明
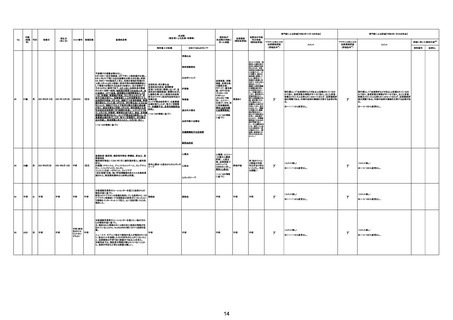
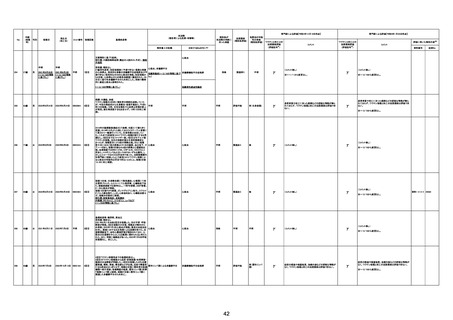
4回目
基礎疾患:糖尿病、高血圧
2022/8/28 19時頃に涎を垂らした状態で傾眠傾向となった
ため、救急搬送。頭部MRI撮像され、右小脳半球、右橋に脳
梗塞を認めたため、同日転院。入院時に撮像したMRIで拡散
強調像では右小脳半球、右橋、左中脳傍正中領域に梗塞を
認めた。来院時に撮像した頭部MRAで左椎骨動脈の紡錘状
拡大を呈していたため、出血の危険性があると判断し29日の
時点では、抗血小板薬は開始せずエダラボン投与を行った。
また入院時に撮像していた胸腹部CTで両肺野に広範にすり
ガラス影を認めており、肺炎を疑う所見であった。また採血で
も軽度炎症反応の上昇を認めていた。誤嚥性肺炎を併発して
いる可能性を考慮し、CTRX1g×1/日開始した。しかし30日の
10時にJCSⅢー300に意識レベルの低下と上下肢MMT0 に麻
痺症状の悪化を認めた。撮像した頭部CTでは入院時に認め
ていた脳梗塞部位に加えて、両側橋、両側小脳半球、両側視 脳幹梗塞
床に低信号域を認めており、脳梗塞拡大を認めた。また体温
も40.2度と上昇していたため、抗生剤は奏功していないと判断
し、TAZ/PIPC4.5g×3/日にescalationした。脳梗塞の拡大を
認めたため、家族に出血リスクを説明し、30日より抗血小板剤
(バイアスピリン100mg/日)を開始した。しかし、8/30 21:58か
らモニター上で徐々に心拍数の低下を認め、22:05に死亡し
た。死後13時間で病理解剖を行った。左椎骨動脈は器質化石
灰化病変を認めるのみで脳動脈解離は認めなかった。中脳や
橋には虚血に伴う壊死組織を認めた。上小脳動脈と後大脳動
脈に新鮮な赤色血栓を認めた。心臓には弁膜症は認めず左
房の軽度拡張や乳頭筋には軽度の瘢痕を認めるが、心内血
栓などは指摘できなかった。また肉眼所見で両肺野には軽度
の炎症性変化を認めたが、肺炎は比較的軽度であり、死因は
脳幹梗塞によるものと判断した。
脳幹梗塞
病理解剖
評価不能
有(発作性心房
細動の有無が
不明。動脈硬化
性変化は強
かった)
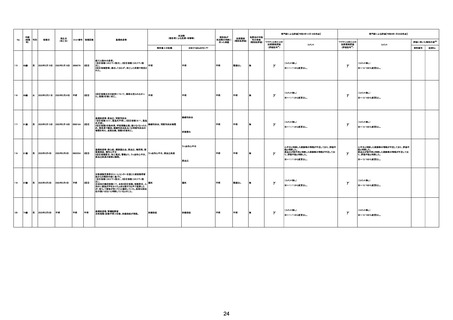
不明
2022年2月4日
2022年2月21日 不明
(~1/20の情報に (~1/20の情報に
基づく。)
基づく。)
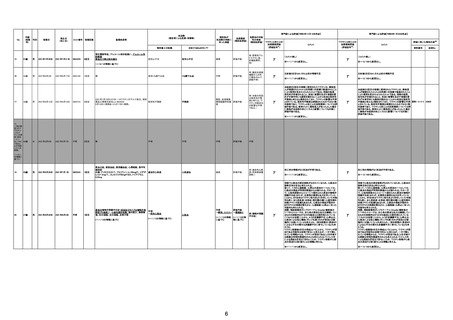
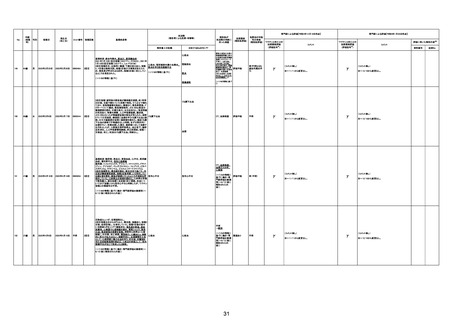
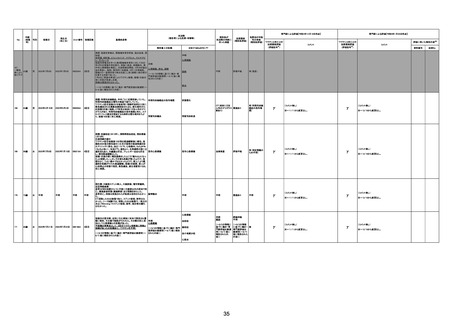
専門家による評価【令和4年12月16日時点】
報告医が
死因等の判断に
至った検査
不明
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
専門家による評価【令和5年1月20日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
資料番号
症例No
不明
関連あり
無
(~1/20の情報 (~1/20の情報
に基づく。)
に基づく。)
関連なし
評価不能
有
γ
基礎疾患の程度、8/23の採血結果、その他の検査の有
無等について情報不足であり、因果関係を判断すること
は困難である。
γ
基礎疾患の程度、8/23の採血結果、その他の検査の有
無等について情報不足であり、因果関係を判断すること
は困難である。
※~12/16から変更なし。
-
-
γ
(コメント無し)
-
-
γ
TTSとして報告されていますが、血小板減少が新たに発
資料1-2-2-4 25679
症していないことから、ブライトン分類を「5」と評価します。
資料1-2-2-4 25619
注1:各症例の記載は、令和3年5月22日~令和4年11月13日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年11月13日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注4:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1-1-2や資料1-2-2の「症状名(PT)」とは異なることがある。
注5:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注6:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注7:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注8:接種医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:搬送医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
43
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
死因等
(報告者による見解・考察等)
基礎疾患等
報告書上の記載
210
※
No.102と
同一の
症例に
つき、
No.102
に統合
211
212
20代
24歳
(~1/20
女
の情報
に基づ
く。)
84歳
男
不明
2022年8月22日
2022年8月27日
000317A
70歳
男
2022年3月6日
2022年3月7日
213
※No.23
と同一
の症例 30歳
につき、
No.23に
統合
男
不明
不明(接種3日後) 不明
214
70歳
男
2022年8月28日
2022年8月30日
000026A
000261A
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
3回目
原疾患等:軽度精神遅滞
5日間の進行性の食欲不振、呼吸困難、見当識障害が
あった。患者の上肢に点状出血および紫斑が発現した。
本剤接種後17日後に、入院した。病院到着後、患者の 血栓性血小板減少性紫斑病
意識と呼吸不全は急速に悪化した。コルチコステロイド
療法を受けたが、心肺停止に陥り、入院から 6 時間後に
死亡。
血栓性血小板減少性紫斑病
不明
4回目
基礎疾患:アルツハイマー型認知症、不安焦燥型うつ
病、糖尿病、糖尿病性腎症、糖尿病性網膜症、脳梗塞
後遺症、慢性心不全
精神的に落ち着かず、ワクチン接種の約2ヶ月前に精神
病棟に入院。症状やや軽快傾向で内科病棟で退院先と
なる特養への退院準備のためのリハビリを開始している
不明
状態だった。退院前のワクチン接種を希望され、ワクチ
ンを接種。翌日から食欲低下が見られ食事量がやや減
少していたため、補液を行っていた。ワクチン接種 5日
後の16時、16時半訪室時には普通の会話をしていた
が、16:55訪室時、血液低下、心拍60に低下。その後、
すぐに心停止となり死亡。
不明
不明
3回目
接種翌日心肺停止で搬送。胃静脈瘤破裂による死亡疑
胃静脈瘤破裂
い。
胃静脈瘤破裂
不明
評価不能
不明
2回目
2回目の投与を受けた。発熱を発現。仕事を休んで翌日
も休んでいた。夕方に帰宅し、通常通りに夕食を摂取し、
不明
自室に向かった。3日後患者は目覚めず、家族が行った
時に死亡しているのが発見された。
不明
剖検
不明
不明
4回目
基礎疾患:糖尿病、高血圧
2022/8/28 19時頃に涎を垂らした状態で傾眠傾向となった
ため、救急搬送。頭部MRI撮像され、右小脳半球、右橋に脳
梗塞を認めたため、同日転院。入院時に撮像したMRIで拡散
強調像では右小脳半球、右橋、左中脳傍正中領域に梗塞を
認めた。来院時に撮像した頭部MRAで左椎骨動脈の紡錘状
拡大を呈していたため、出血の危険性があると判断し29日の
時点では、抗血小板薬は開始せずエダラボン投与を行った。
また入院時に撮像していた胸腹部CTで両肺野に広範にすり
ガラス影を認めており、肺炎を疑う所見であった。また採血で
も軽度炎症反応の上昇を認めていた。誤嚥性肺炎を併発して
いる可能性を考慮し、CTRX1g×1/日開始した。しかし30日の
10時にJCSⅢー300に意識レベルの低下と上下肢MMT0 に麻
痺症状の悪化を認めた。撮像した頭部CTでは入院時に認め
ていた脳梗塞部位に加えて、両側橋、両側小脳半球、両側視 脳幹梗塞
床に低信号域を認めており、脳梗塞拡大を認めた。また体温
も40.2度と上昇していたため、抗生剤は奏功していないと判断
し、TAZ/PIPC4.5g×3/日にescalationした。脳梗塞の拡大を
認めたため、家族に出血リスクを説明し、30日より抗血小板剤
(バイアスピリン100mg/日)を開始した。しかし、8/30 21:58か
らモニター上で徐々に心拍数の低下を認め、22:05に死亡し
た。死後13時間で病理解剖を行った。左椎骨動脈は器質化石
灰化病変を認めるのみで脳動脈解離は認めなかった。中脳や
橋には虚血に伴う壊死組織を認めた。上小脳動脈と後大脳動
脈に新鮮な赤色血栓を認めた。心臓には弁膜症は認めず左
房の軽度拡張や乳頭筋には軽度の瘢痕を認めるが、心内血
栓などは指摘できなかった。また肉眼所見で両肺野には軽度
の炎症性変化を認めたが、肺炎は比較的軽度であり、死因は
脳幹梗塞によるものと判断した。
脳幹梗塞
病理解剖
評価不能
有(発作性心房
細動の有無が
不明。動脈硬化
性変化は強
かった)
不明
2022年2月4日
2022年2月21日 不明
(~1/20の情報に (~1/20の情報に
基づく。)
基づく。)
専門家による評価【令和4年12月16日時点】
報告医が
死因等の判断に
至った検査
不明
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
専門家による評価【令和5年1月20日時点】
評価に用いた報告内容注2
ワクチンと死亡との
因果関係評価
(評価記号★)
コメント
資料番号
症例No
不明
関連あり
無
(~1/20の情報 (~1/20の情報
に基づく。)
に基づく。)
関連なし
評価不能
有
γ
基礎疾患の程度、8/23の採血結果、その他の検査の有
無等について情報不足であり、因果関係を判断すること
は困難である。
γ
基礎疾患の程度、8/23の採血結果、その他の検査の有
無等について情報不足であり、因果関係を判断すること
は困難である。
※~12/16から変更なし。
-
-
γ
(コメント無し)
-
-
γ
TTSとして報告されていますが、血小板減少が新たに発
資料1-2-2-4 25679
症していないことから、ブライトン分類を「5」と評価します。
資料1-2-2-4 25619
注1:各症例の記載は、令和3年5月22日~令和4年11月13日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年11月13日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注4:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1-1-2や資料1-2-2の「症状名(PT)」とは異なることがある。
注5:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注6:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注7:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注8:接種医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:搬送医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
43