よむ、つかう、まなぶ。
資料4-3 企業から提出された開発工程表の概要等(第I回要望) (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00026.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第54回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
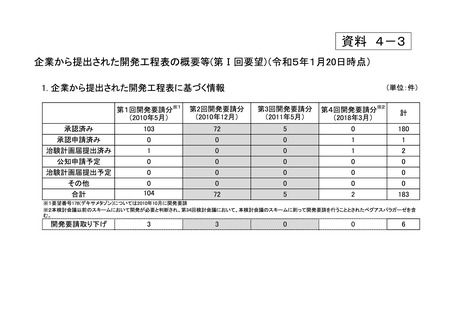
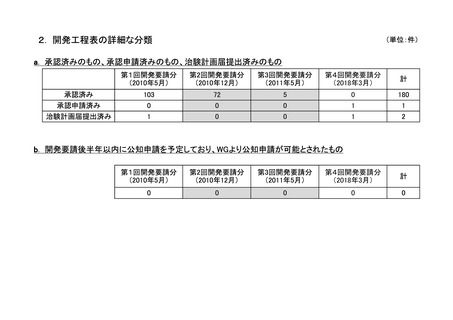
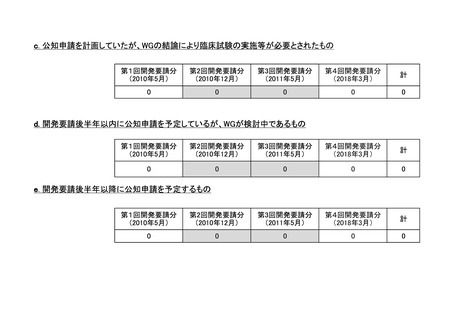
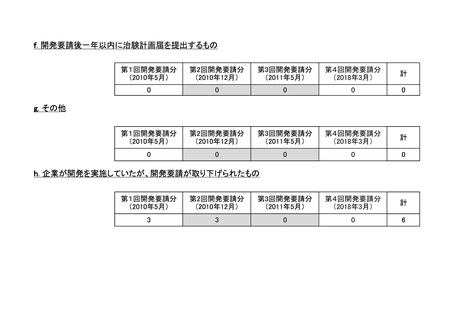
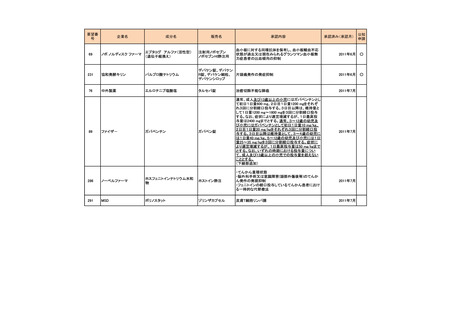
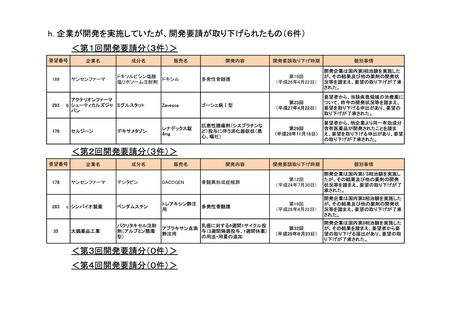
h. 企業が開発を実施していたが、開発要請が取り下げられたもの(6件)
<第1回開発要請分(3件)>
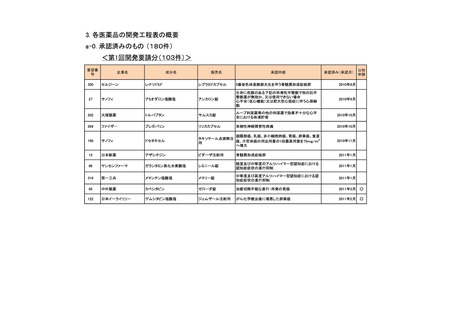
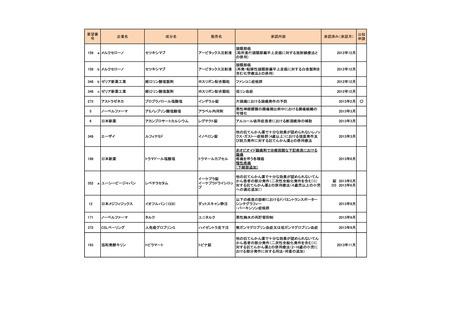
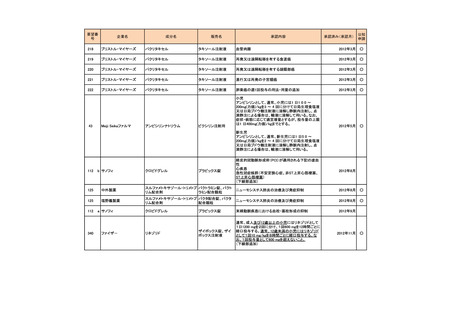
要望番号
189
293
企業名
ヤンセンファーマ
成分名
セルジーン
開発要請取り下げ時期
個別事情
多発性骨髄腫
第19回
(平成26年4月22日)
開発企業は国内第I相治験を実施した
が、その結果及び他の薬剤の開発状
況等を踏まえ、要望の取り下げが了承
された。
Zavesca
ゴーシェ病Ⅰ型
第23回
(平成27年4月22日)
要望者から、当該疾患領域の治療薬に
ついて、昨今の開発状況等を踏まえ、
要望を取り下げる申出があり、要望の
取り下げが了承された。
レナデックス錠
4mg
抗悪性腫瘍剤(シスプラチンな
ど)投与に伴う消化器症状(悪
心、嘔吐)
第29回
(平成28年11月16日)
要望者から、他企業より同一有効成分
含有医薬品が開発されたことを踏ま
え、要望を取り下げる申出があり、要望
の取り下げが了承された。
開発要請取り下げ時期
個別事情
開発企業は国内第I/II相治験を実施し
たが、その結果及び他の薬剤の開発
状況等を踏まえ、要望の取り下げが了
承された。
ドキソルビシン塩酸
ドキシル
塩リポソーム注射剤
アクテリオンファーマ
b シューティカルズジャ ミグルスタット
パン
176
販売名
デキサメタゾン
開発内容
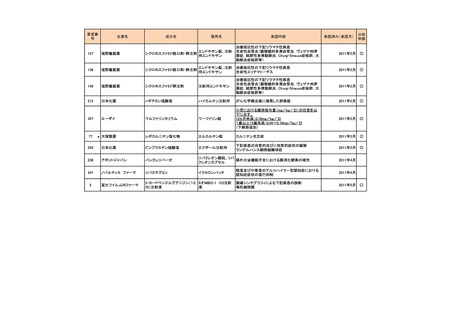
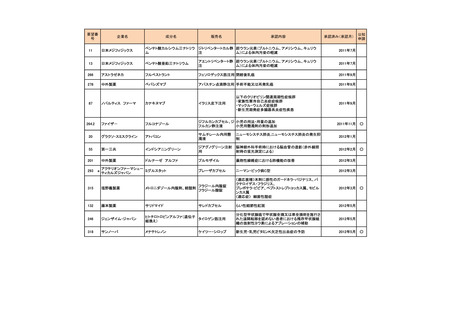
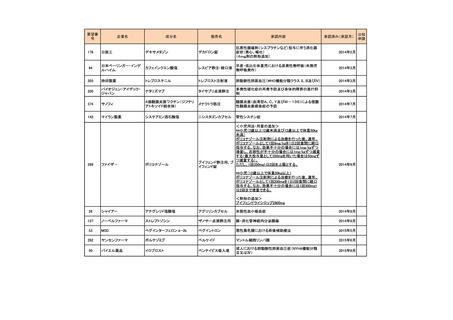
<第2回開発要請分(3件)>
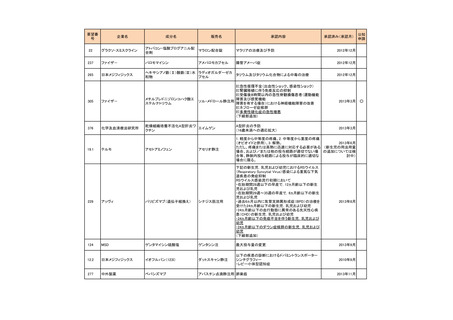
要望番号
178
283
35
企業名
ヤンセンファーマ
c シンバイオ製薬
大鵬薬品工業
成分名
販売名
開発内容
デシタビン
DACOGEN
骨髄異形成症候群
第12回
(平成24年7月30日)
ベンダムスチン
トレアキシン静注
用
多発性骨髄腫
第19回
(平成26年4月22日)
開発企業は国内第II相治験を実施した
が、その結果及び他の薬剤の開発状
況等を踏まえ、要望の取り下げが了承
された。
パクリタキセル注射
剤(アルブミン懸濁
型)
乳癌に対する4週間1サイクル投
アブラキサン点滴
与(3週間隔週投与、1週間休薬)
静注用
の用法・用量の追加
第32回
(平成29年8月23日)
開発企業は国内第II相治験を実施した
が、その結果を踏まえ、要望者から要
望の取り下げる届出があり、要望の取
り下げが了承された。
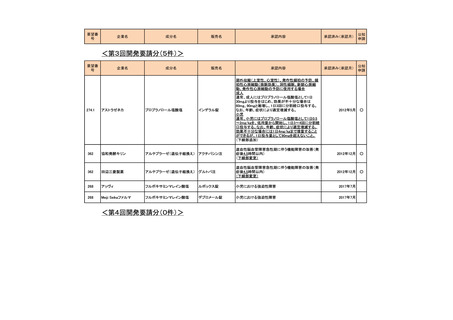
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>
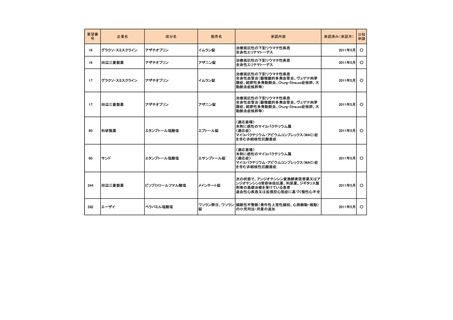
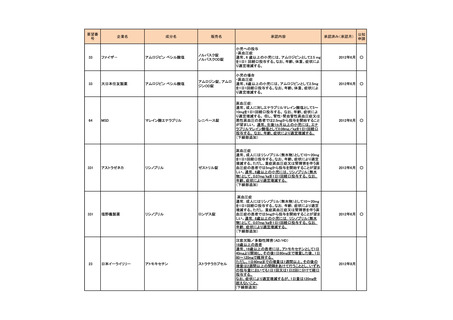
<第1回開発要請分(3件)>
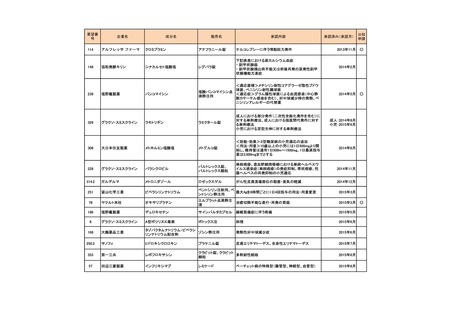
要望番号
189
293
企業名
ヤンセンファーマ
成分名
セルジーン
開発要請取り下げ時期
個別事情
多発性骨髄腫
第19回
(平成26年4月22日)
開発企業は国内第I相治験を実施した
が、その結果及び他の薬剤の開発状
況等を踏まえ、要望の取り下げが了承
された。
Zavesca
ゴーシェ病Ⅰ型
第23回
(平成27年4月22日)
要望者から、当該疾患領域の治療薬に
ついて、昨今の開発状況等を踏まえ、
要望を取り下げる申出があり、要望の
取り下げが了承された。
レナデックス錠
4mg
抗悪性腫瘍剤(シスプラチンな
ど)投与に伴う消化器症状(悪
心、嘔吐)
第29回
(平成28年11月16日)
要望者から、他企業より同一有効成分
含有医薬品が開発されたことを踏ま
え、要望を取り下げる申出があり、要望
の取り下げが了承された。
開発要請取り下げ時期
個別事情
開発企業は国内第I/II相治験を実施し
たが、その結果及び他の薬剤の開発
状況等を踏まえ、要望の取り下げが了
承された。
ドキソルビシン塩酸
ドキシル
塩リポソーム注射剤
アクテリオンファーマ
b シューティカルズジャ ミグルスタット
パン
176
販売名
デキサメタゾン
開発内容
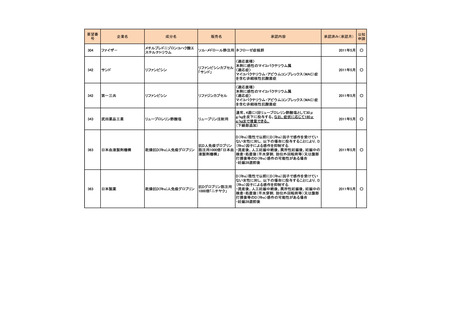
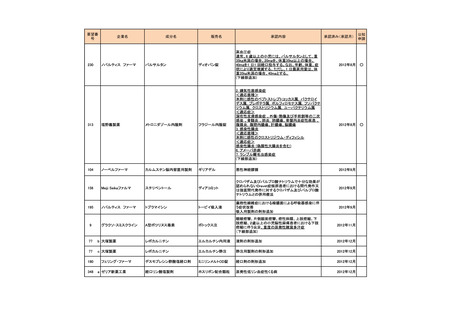
<第2回開発要請分(3件)>
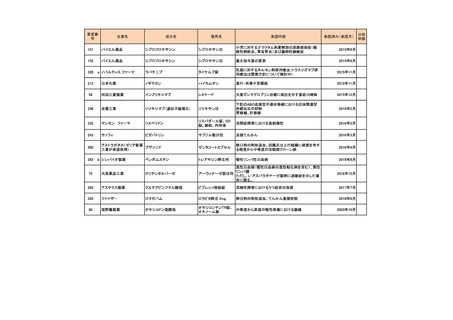
要望番号
178
283
35
企業名
ヤンセンファーマ
c シンバイオ製薬
大鵬薬品工業
成分名
販売名
開発内容
デシタビン
DACOGEN
骨髄異形成症候群
第12回
(平成24年7月30日)
ベンダムスチン
トレアキシン静注
用
多発性骨髄腫
第19回
(平成26年4月22日)
開発企業は国内第II相治験を実施した
が、その結果及び他の薬剤の開発状
況等を踏まえ、要望の取り下げが了承
された。
パクリタキセル注射
剤(アルブミン懸濁
型)
乳癌に対する4週間1サイクル投
アブラキサン点滴
与(3週間隔週投与、1週間休薬)
静注用
の用法・用量の追加
第32回
(平成29年8月23日)
開発企業は国内第II相治験を実施した
が、その結果を踏まえ、要望者から要
望の取り下げる届出があり、要望の取
り下げが了承された。
<第3回開発要請分(0件)>
<第4回開発要請分(0件)>