よむ、つかう、まなぶ。
資料2.緊急時の薬事承認の在り方 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22281.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第1回 11/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
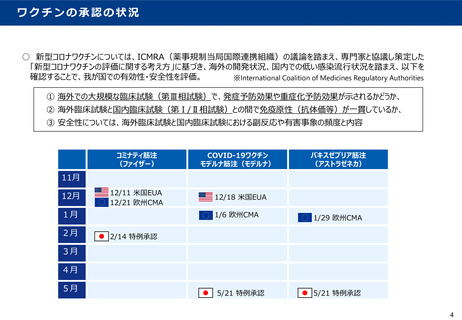
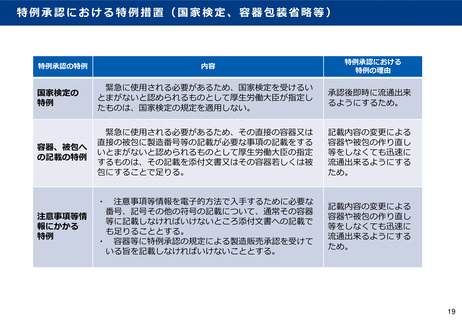
「新型コロナウイルスワクチンの評価に関する考え方」について②
<安全性評価>
○ 接種から少なくとも7日間に認められた特定の局所反応(腫脹、発赤、硬結、疼痛等)、
特定の全身反応(発熱、頭痛、倦怠感、筋肉痛等)及び少なくとも28日間に認められた
有害事象を収集。ワクチン候補の特性等に応じて、それ以上の期間の設定もあり得る。
<臨床試験中のフォローアップ>
○ 接種後の長期的な有効性・安全性に関する情報を収集するため、臨床試験において、
少なくとも1年間のフォローアップの計画が必要。抗体価の持続等に関する情報、疾患増
強のリスク評価を含む有害事象の情報を収集することが求められる。
<疾患増強(抗体依存性感染増強(ADE))>
○ 臨床試験の前に、非臨床薬理試験において実施した免疫(Th1/Th2)バランス等を評
価し、疾患増強に関するリスクの見積りを行うことが必要。
○
新たな知見が得られた場合は、適宜、新たな方法による評価を検討。
<薬物動態試験※>
※ 投与薬剤の血中濃度の推移や生体内分布、代謝などの状況を確認する試験
○ mRNAワクチン、DNAワクチン、組換えウイルスワクチンについては、投与後の生体
内分布に関する評価が必要。
(注)これらのワクチンは、抗原タンパク質そのものを接種する既存のワクチンと異なり、体内の細胞に入りこみ抗原タンパク質を
産生するため、予期しない部位でタンパク質が産生し、人体への影響を及ぼす可能性があることから、生体内分布の評価が必要。
13
<安全性評価>
○ 接種から少なくとも7日間に認められた特定の局所反応(腫脹、発赤、硬結、疼痛等)、
特定の全身反応(発熱、頭痛、倦怠感、筋肉痛等)及び少なくとも28日間に認められた
有害事象を収集。ワクチン候補の特性等に応じて、それ以上の期間の設定もあり得る。
<臨床試験中のフォローアップ>
○ 接種後の長期的な有効性・安全性に関する情報を収集するため、臨床試験において、
少なくとも1年間のフォローアップの計画が必要。抗体価の持続等に関する情報、疾患増
強のリスク評価を含む有害事象の情報を収集することが求められる。
<疾患増強(抗体依存性感染増強(ADE))>
○ 臨床試験の前に、非臨床薬理試験において実施した免疫(Th1/Th2)バランス等を評
価し、疾患増強に関するリスクの見積りを行うことが必要。
○
新たな知見が得られた場合は、適宜、新たな方法による評価を検討。
<薬物動態試験※>
※ 投与薬剤の血中濃度の推移や生体内分布、代謝などの状況を確認する試験
○ mRNAワクチン、DNAワクチン、組換えウイルスワクチンについては、投与後の生体
内分布に関する評価が必要。
(注)これらのワクチンは、抗原タンパク質そのものを接種する既存のワクチンと異なり、体内の細胞に入りこみ抗原タンパク質を
産生するため、予期しない部位でタンパク質が産生し、人体への影響を及ぼす可能性があることから、生体内分布の評価が必要。
13