よむ、つかう、まなぶ。
参考資料14 定期の予防接種等による副反応疑いの報告等の取扱いについて(平成25年3月30日付け健発0330第3号・薬食発0330第1号厚生労働省健康局長及び医薬食品局長連名通知。最終改正:令和4年10月24日) (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00059.html |
| 出典情報 | 第92回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第27回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(3/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
バージョン 1.00
定期接種・臨時接種の場合で報告基準に該当する場合に○がついています。ご確認ください。
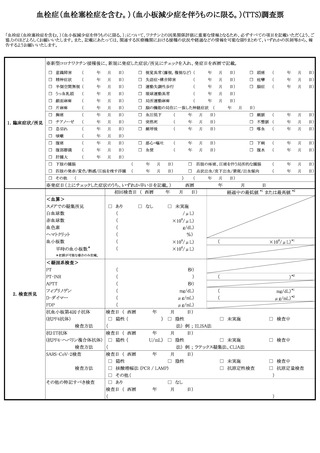
症
状
発生
日時
発生まで
の日数
本剤との
因果関係
他要因(他の疾患等)の
可能性の有無
概要 (症状・徴候・臨床経過・診断・検査等)
製造販売業者への情報提供
症状の
概 要
程
症状の
程 度
度
1.死亡
2.障害
3.死亡につながるおそれ
4.障害につながるおそれ
5.入院
6.上記1〜5に準じて重い
病院名
入
院 医師名
の
場 入院日
合
退院日
7.後世代における先天性の疾病又は異常
転帰日
後
遺
症
(
症状の
転帰
症
状
)
1.回復
2.軽快
3.未回復
4.後遺症
5.死亡
6.不明
報告者
意見
報告回数
医療機関名
年齢
( 歳)
性別
印刷日時:
20xx/xx/xx xx:xx
定期接種・臨時接種の場合で報告基準に該当する場合に○がついています。ご確認ください。
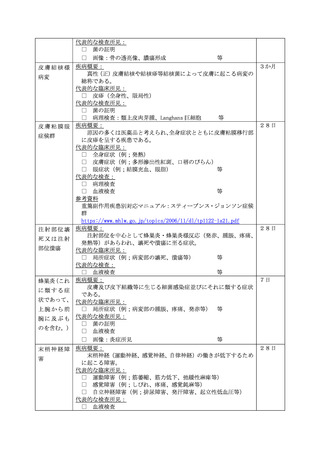
症
状
発生
日時
発生まで
の日数
本剤との
因果関係
他要因(他の疾患等)の
可能性の有無
概要 (症状・徴候・臨床経過・診断・検査等)
製造販売業者への情報提供
症状の
概 要
程
症状の
程 度
度
1.死亡
2.障害
3.死亡につながるおそれ
4.障害につながるおそれ
5.入院
6.上記1〜5に準じて重い
病院名
入
院 医師名
の
場 入院日
合
退院日
7.後世代における先天性の疾病又は異常
転帰日
後
遺
症
(
症状の
転帰
症
状
)
1.回復
2.軽快
3.未回復
4.後遺症
5.死亡
6.不明
報告者
意見
報告回数
医療機関名
年齢
( 歳)
性別
印刷日時:
20xx/xx/xx xx:xx